 > Техника, страница 87 > Углекислота
> Техника, страница 87 > Углекислота
Углекислота
Углекислота, технич. наименование двуокиси углерода С02 (угольный ангидрид, углекислый газ). У.—соединение, весьма распространенное в природе и играющее очень важную роль в геологии., биологич. и технологии. процессах. В атмосферном воздухе (сухом) содержится-0,03% по объёму или (3,046% по весу С02; в морской воде--90 г С02 в 1 лГ.
Концентрированная У. во многих местах выделяется из скважин земной коры на ее поверхность в газообразном виде или в виде Пересы-· щенных водных растворов. У. образуется при процессах горения и гниения органич. веществ и при дыхании животных; в воздухе, выдыхаемом из легких, содержится ~ 4% С02; человек за сутки выдыхает 800—900 я С02, a при усиленной физич. работе до 1 500 з. Производные У.—карбонаты металлов (гл. обр. Са и Mg)—имеют огромное распространение в земной коре (смотрите Углерод). У. находит технич. применение во всех трех агрегатных состояниях— газообразном, жидком и твердом.
Физические свойства. У.—бесцветный газ с едва ощутимым запахом, при растворении в воде—со слабым кисловатым вкусом. Плотность по отношению к воздуху А =1,524 (0°, 760 миллиметров); 1 л С02 при нормальных условиях весит 1,97686 з; вязкость η=0,000139 (в единицах CGS, при 0°); коэф. диффузии в воздухе (при 0°) 0,142; звукопроводность (при 0°) 258 м/ск. Удельная теплоемкость ер при —75° — 0,184, при 0°—0,188, при 1 000°—0,272, при 2 000°—0,356 cal/з; молекулярная теплоемкость (для 0°): Ср=8,27, С„=6,26 cal/моль. Теплопроводность С02 равна 0,000033 cal/см ск. °С. Коэф. преломления nD=1,00045; молекулярная рефракция Дл=6,68; диэлектрич. постоянная е=1,001 (0°,760 ли). Растворимость С02 в воде (под атмосферным давлением): при 0°—171, при 15°—102, при 20°—88, при 30°—66, при 60°—36 объёмов в 100 объёмах Н20; при повышении давления растворимость увеличивается, следуя до ~ 14 atm закону Генри. В растворах, содержащих органич. коллоиды (например в пиве, квасе), растворимость С02 м. б. заметно выше толысо-что указанной, что объясняется адсорб цией У. на коллоидных частицах. Теплота растворения С02 в воде равна 5 630 cal/.моль. В 1 объёме а растворяется при 0°—4,3 объёма, при 20°—2,9 объёма С02. Обратить У. в жидкость возможно только с помощью давления; одним охлаждением У. переводится прямо в твердое состояние. Также и твердая У. при повышении 1° обращается в газ, не плавясь, т. к. ее £°ил. (ок. -56°) лежит выше, чем t°Kun_
( — 78,5°). Упругость пара С02 (или сжижающее давление) равна при: 0°—35 atm, 10°— 44 atm, 15°—52 atm, 20°—56 atm. Критич. давление 72,9 atm t°KVum_ + 31,3°. Сжиженная У. бесцветна и подвижна; ее уд. в.: D_20=1,0; Л»=0,947; Л 5=0,813; Л20=0,772; Л3° =
= 0,46. Отсюда видно, что коэф. расширения жидкой У. очень велик: в интервале ί° 0° -» 30° объём увеличивается в ~ 1,5 раза. Вязкость жидкой У. (при 10°) η=0,00085 единиц CGS (^що =
= 0,013); теплота испарения 47,7 Cal/кг. При испарении 1 килограмм жидкой У. дает 509 л газа или 1 л жидкой У.—462 л газа. Жидкая У. хорошо растворима в эфире и низших ах, но обладает ничтожной растворяющей способностью по отношению к твердым веществам. Твердая У., образующаяся легче всего при быстром испарении жидкой У., —снегообразная мел-кокристаллич. масса; уд. в Л0_79=1,53;<°,ы. (под давлением 5,1 atm) равна —56,7°; (возгонки) равна —78,5°; теплота плавления 45,3 cal/г; теплота испарения (при —78,5°) 136,9 cal/г.
Химические свойства. У.—соединение неполярное; молекула С02 имеет поперечник 3,2 А, причем атом С лежит в центре, атомы же О расположены диаметрально, на удалении 1,59 А от С. Устойчивость У. весьма значительна даже при высоких f°: термич. диссоциация ее по ур-ию 2СОа 2С0+02 начинается ок. 1 200°; при 2 600° распадается ок. 50%, а при 2 800° ок. 75% С02. Будучи высшим окислом углерода, У. неспособна к дальнейшему окислению; восстановителями же она м. б. переведена в различные продукты. Так, С02 восстанавливается: углем при <°>450° до окиси углерода СО, щелочными и щелочноземельными металлами при краснокалильном жаре—до свободного углерода, водородом при 300—400° на Ni-катализаторе—до метана (а под давлением 200—300 atm также и до метанола). Метал-лич. калий и магний горят в атмосфере С02, выделяя углерод в виде сажи. В природе С02ассимилируется растениями (при фотокатали-тическом содействии хлорофилла), восстанавливаясь при обыкновенной t° в формальдегид СН20, из молекул которого синтезируются углеводы и далее жиры и белки. О круговороте С02в природе см. Углерод.
У. обладает свойствами кислотного окисла и легко соединяется с щелочными оки и с щелочами в соответствующие соли двухосновной угольной кислоты Н2С03. Свободная угольная к-та образуется в незначительных количествах при растворении С02 в воде согласно ур-ию С02 + Н20 2: Н2С03; она дает слабокислую реакцию на лакмус вследствие ионизации по схеме Н2С03^Н + НС03. Угольная к-та образует соли вида Ме2С03 (карбонаты) и МеНС03 (бикарбонаты); в растворах самой Н2С03и бикарбонатов имеются анионы НС03, в растворах же карбонатов—анионы С03. Молекулярная рефракция RB для иона СОз равна 12,27. Все карбонаты, кроме щелочных, нерастворимы в воде; при нагревании ниже tnj, они распадаются на окись металла и С02 (исключая NaaC03 и К2С03) и выделяют С02при действии к-т. Бикарбонаты лучше растворимы и легче распадаются (даже при кипячении их растворов). Н2С03 принадлежит к числу слабых к-т; константа ее диссоциации К на. основе экспериментальных данных обычно принималась равной 3- 1(Г7 (при 18°), что однако не соответствует действительности, т. к. при этом не учитывался % негидратированной С02 в растворе. Истинная величина К должен быть примерно в 1 000 раз больше указанной, то есть угольная к-та на деле сильнее муравьиной, практически же ничтожная сила Н2С03 обусловлена почти полным распадом ее на С02 и Н20; так, даже при t°, близкой к 0°, лишь 0,5—0,6% всей растворенной С02 образует Н2С03, а при ί°== 100° Н2С03 не существует.
У.—газ физиологически почти инертный: ядовитостью в прямом смысле она(вопреки распространенному мнению) не обладает. Малые концентрации С02 в воздухе стимулируют работу дыхательного центра, высокие же (> 1%) концентрации вызывают нек-рые нарушения физиологич. обмена, из-за чего У. может рассматриваться как бытовая, а иногда и профессиональная вредность. Содержание С02 в воздухе до 1 % не вызывает опасных явлений и м. б. допускаемо в течение нескольких часов, хотя всякое повышение его сверх обычной нормы (0,03—0,04%) ухудшает самочувствие и временно понижает работоспособность организма. Пламя свечи тухнет в воздухе, содержащем 6—12% С02, пламя газовой горелки—при содержании >30% С02.
Получение У. Природная У. утилизируется лишь при наличии богатых источников концентрированного натурального газа. Гораздо чаще У. получается химич. путем, для чего используют следующие реакции: а) горение углерода или органич. веществ, б) термич. разложение карбонатов, в) действие к-т на карбонаты и г) процессы брожения углеводов. Для лабораторных целей С02 получают, разлагая СаС03, NaHC03 или Na,2C03 соляной или серной к-той. Для промышленного использования У. чаще всего вырабатывается на месте потребления; на рынке обращается лишь менее 1% всей расходуемой У., притом исключительно в жидком или твердом виде. Промышленное производство У. базируется на следующих исходных материалах: 1) газы известеобжигательных печей (содержат до 40% С02), 2) газы специальных топок, работающих на коксе или антраците (до 18% С02), 3) дымовые газы обычных котельных установок (3—12% С02), 4) газы брожения, 5) отбросная У. при получении водорода из водяного газа (на з-дах синтетич. аммиака), 6) У., получаемая из СаС03 + 2НС1, и
7) натуральный газ углекислых источников. Последние два источника имеют второстепенное значение и используются гл. обр. для нужд пищевой и химико-фармацевтич. пром-сти.
Производство газообразной У. Наибольшие количества У. получаются обжигом известняка в шахтных известеобжигательных печах (смотрите Известь) или магнезита и доломитов в ретортных либо вращающихся печах, а также из продуктов горения угля или кокса. Процесс обжига известняка основан на обратимой реакции СаС03 ?i СаО + С02, которая слева направо протекает эндотермически. Равновесие системы зависит от парциального давления С02, которая поэтому должен быть непрерывно удаляема из реакционной зоны (тяга). Упругость диссоциации СаС03 (в миллиметров Hg) равна: при 500° - 20; при 700°—50;при 800°—195; 900’—1700; 1 000°— 2 830 миллиметров. Т. о. под атмосферным давлением диссоциация начинается при t° > 800°; на практике обжиг ведут при 1 000—1 200°. При оптимальном, достаточно малом расходе горючего (кокса) содержание С02 в отходящих газах м. б. доведено до 40% по объёму; эта У. получается: а) за счет диссоциаций СаС03 и б) за счет сгорания топлива. Расход горючего (в перерасчете на углерод) колеблется в пределах 7 -у 15% веса СаС03; соответственно этому меняется концентрация С02 в получаемом газе. Ниже приводятся данные о расходе углерода (в килограммах) на обжиг 100 гг СаС03 и соответственное содержание С02 в отходящем газе (в объёмных %):
Расход углерода 7 8 9 10 11 12 13 14 15 Содержание С02 41,8 40,0 38,2 38,8 35,6 34,7 33,7 32,9 32,3
Контроль работы печей на У. заключается в определении С02 в газах прибором Орса (смотрите Анализ газов) с NaOH или при помощи автома-тич. газоанализатора. Вследствие сильной запыленности получаемый газ должен обязательно подвергаться тщательной промывке, либо ме-ханич. фильтрации, либо электрофильтрации. Газообразная У. в продажу не поступает и не перевозится.
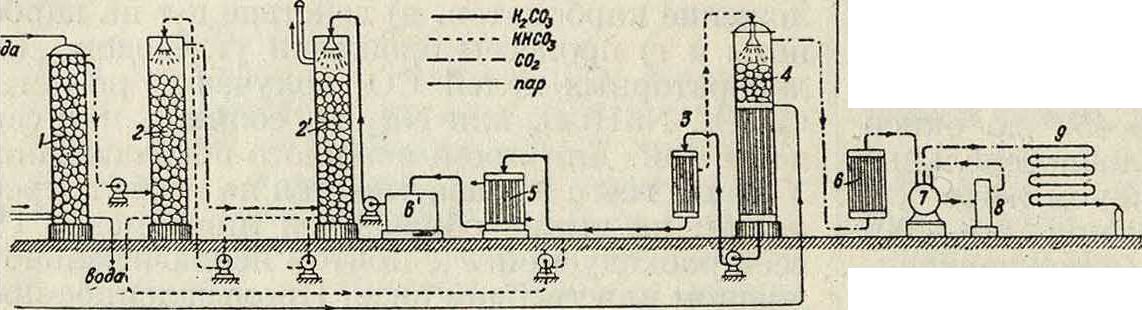
Производство жидкой У. Для сжижения У. берут концентрированный газ с содержанием С02 выше 95%. Концентрирование У. производят почти всегда химич. путем, поглощая С02 из первичного газа (содержащего в большом количестве азот) раствором поташа и разлагая полученный бикарбонат кипячением:
I. К2С03 + Н30 + С02->-2КНС03,
II. 2КНС03->-КаС03 + Н20 + С02.
Типичная схема установки для обогащения и сжижения У. показана на фигуре 1. Горячие га дильник 9, из которого жидкая У. поступает непосредственно на разливку. Практич. расход К2С03—ок. 2 килограмма на 1 тонна У. Тара для хранения и перевозки жидкой У.—стальные баллоны.
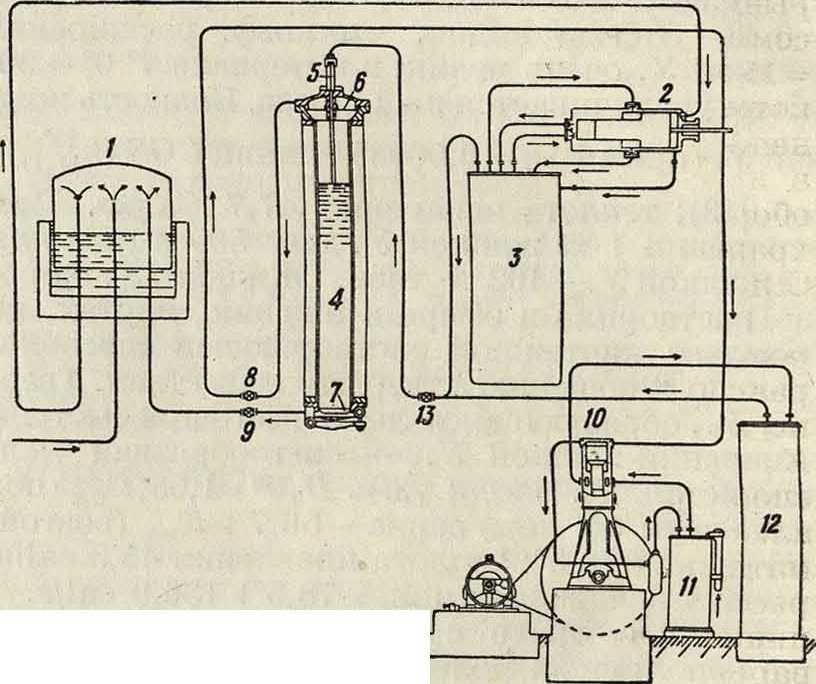
Производство твердой У. Твердая У. выпускается на рынок под названием сухого льда. Фабрикация этого продукта слагается из следующих основных операций: а) получение чистой У., б) сжижение ее, в) превращение жидкой У. в твердое состояние за счет частичного испарения (и рекуперация испарившейся части), г) формовка твердой У. и д) упаковка. Имеется несколько типов аппаратуры для этого производства. По способу,
Фигура 2.
Фигура 1.
зы, полученные сжиганием топлива или другим термин, путем, в скруббере 1 промываются водой, охлаждаясь при этом до 30—40°, затем проходят последовательно через 2—4 абсорбера 2, 2, орошаемых 10—15%-ным раствором К2С03, с ί° 45—50°; т. о. связывается 50—70% всей С02 в виде КНС03. Раствор КНС03 проводится через теплообменник 3, где подогревается до - 75° и поступает в диссоциатор 4, имеющий внизу обогрев глухим паром, а вверху кварцевую насадку; здесь до 75% бикарбоната распадается, освобождая С02. Вытекающий из диссоциатора щелок, обогащенный К2С03, отдает избыточное тепло в теплообменнике 3 и в водяном холодильнике 5. охлаждаясь до - 50’, п через бак в вновь идет для орошения абсорбера 2. Обогащенная У. из 4 направляется в холодильник и и далее в компрессор 7. Обычно применяют двухступенную (10— 50 atm) или, чаще, трехступенную компрессию, пропуская газ после 1-го сжатия через осушитель 8, а после окончательного—через холо осугцествленному швейцарской фирмой «Кар-ба», жидкая У. подвергается 2-ступенному испарению. Сначала она проводится через специальное сопло (диффузор), где давление снижается лишь до величины 5,28 atm, отвечающей тройной точке С02; при этом часть У., превращается в пластич. влажный «снег», к-рый силою струи сбивается в плотные комья и при вторичном понижении давления до 1 atm застывает в компактные «ледяные» блоки. Схема этой установки дана на фигуре 2. Из газгольдера 1 У. проходит трехступенный компрессор 2, затем ожижающий холодильник 3 и поступает в льдогенератор 4 через сопло 5, снабженное диффузором (фигура 3), где частично превращается в снег. Испарившаяся часть С02 через верхний фильтр 6 отводится на нижнюю ступень компрессора. Сечения диффузора подобраны так, что на участке I (фигура 3) происходит расширение и частичная кристаллизация жидкой С02; полученный мокрый снег выбрасывается через сопло 2 (фигура 3) на нижний фильтр ^
7 и постепенно за- [~Т
полняет цилиндр 4. В нужный момент прекращают фиг- 3.
подачу С02 (вентилем 13), закрывают шибер
8 и открывают 9, сообщая т. о. подфильтровое пространство с нижней ступенью компрессора 2: давление падает, и блок С02 смерзается в плотную массу за счет испарения остававшейся в нем жидкой С02. Тогда закрывают шибер 9 и открывают нижнюю крышку генератора, причем готовый блок сухого льда медленно выскальзывает в подставленный приемник. Неотвержденная в 5 часть СО» выводится через 8 в дополнительный двухступенный компрессор 10, где проходит 1-е сжатие, холодильник 11, 2-е сжатие и сжижающий холодильник 12, затем через вентиль 13 снова вводится в процесс. Установка с тремя испарительными агрегатами дает в сутки 3—5 тонн твердой У. Производство сухого льда существует с 19?5 г. (США). В настоящее время оно имеется в США (ок. 30 з-дов с общей продукцией до 40 000 тонн), в Германии (8 з-дов), Франции, Швейцарии, Канаде, Мексике, Австралии и Японии. Стандартная форма сухого льда для рынка в США—кубики с ребром 25 см, весом ок. 15 кз или цилиндрики 0 3,5 см, h== 15-У20 см. Тара для них—бумажные пакеты, которые для перевозки укладываются в теплонепроницаемые ящики. Потери при хранении— в пределах 1·—5% за сутки. На специально оборудованных торговых складах твердая У. хранится до % года. Стоимость сухого льда в США—ок. 20 долл, за 1 т.
Применение У. Газообразная У. широко применяется в сахарной пром-сти (для разложения Са-сахарата), в производстве соды по аммиачному способу и бикарбонатов Na и К, в производстве сернокислого алюминия по способу Левига, при получении чистой окиси алюминия из бокситов, в производстве бихромата и перманганата калия, п> и химич. очистке рассолов NaCI (для электролизаидляполучения пищевой соли). Она расходуется также в варенном деле, употребляется для выделения серы из содовых остатков, служит сырьем для технич. синтеза мочевины, метилового а (по реакции С02 + ЗН2=СН30Н + Н2О с катализатором ZnO-f-MgO+Fe2C)3 под давлением до 300 atm), салициловой- кислоты и некоторых других органич. препаратов; предложена как консервирующее средство для пищевых продуктов. В медицине У. имеет значение как составная часть лечебных минеральных вод. Часть У. поступает на сжижение и на производство сухого льда. Жидкая У. непосредственно используется в холодильном деле -и в лабораторной технике, а в последнее время также для горно-подрывных работ. Главным же образом она служит транспортабельной формой С02, используемой на месте потребления в газообразном виде: для производства искусственных минеральных вод, шипучих вин и других газированных напитков, для медицинских ванн и т. д. Твердая У. (сухой лед) применяется почти исключительно как источник холода—на городских холодильниках, консервных з-дах, в складах и магазинах, при перевозке скоропортящихся продуктов, в кондитерском производстве, в комнатных ледниках. Ее применяют также для лабораторного получения низких t° (дает охлаждение до —78°, а в смеси с ацетоном под вакуумом до —110°), в вакуумной технике к для дезинсекции хлебопродуктов (в смеси с окисью этийена). Потребление твердой У. в США за последнее время превышает потребление жидкой. В холодильном деле применение твердой У. взамен льда имеет следующие преимущества: 1) значительно меньший расход охладителя, равный 11 з—!/5 расхода обыкновенного льда; 2) сухость охлаждаемого помещения (твердая У. не тает и потому не дает сырости, грязи и не вызывает коррозии транспортного оборудования или порчи продуктов талой водой); 3) возможность быстрого и глубокого ме стного ох лаждения; 4) консервирующее действие выделяемого газа на продукты; 5) допустимость применения в ручном багаже и почтовых посылках и 6) упрощенная и очень легкая тара, обычно не подлежащая возврату.
Лит.: Свойства углекислоты: Менделеев Д., Основы химии, 9 изд., т. 1, М.—Л., 1927; М е н ш у т-кин Б., Курс общей химии (неорганической), 4 изд., Л., 1933; Никитинский Я., «Пищевая промышленность), М·., 1932, 5, стр. 21, и 6, стр. 78 (У. как консервант для пищевых продуктов); Ephraim Fr., Anorganische Chemie, 4 Aufl., Dresden—Leipzig, 1929; P lank R.u. К uprianoff, Die thermischen Eigen-schaften d. Kohlensaure, B., 1929; Производство углекислоты: Лукьянов П., Курс химич. технологии минеральных веществ, 3 изд., ч. 1, М.—Л., 1933; М е-ликов В., «ЖХП», 1933, 4, етр. 6 (сухой лед); W е п-d ег N., Die Kohlensaureindustrie, В., 1901; Luh·
m a η η Ε., Die Fabrikation d. flussigen Kohlensaure, B., 1904; Goosmann J., The Carbonic Acid Industry, Chicago, 1906; Baum H., Die wirtschaftiiche Bedeutung u. die Handelstechnik d. Kohlensaureindustrie, B., 1911; Dammer O. u. Peters F., Chemische Technologie d. Neuzeit, 2 Aufl., B. 3, B.—Stg., 1927; Plank R., Amerikanische Kaltetechnik, B., 1929; Luckow C.,
«Chemische Apparatur», Lpz., 1 930, B. 17, p. 229 u. 243; Killeffer D., «J. Eng. Chem.», Wsh., 1930, v. 22, p. 1087; Reich G-., «Chem. & Met. Engineering», N. Y., 1931, y. 38, p. 136; Ullm. Enz., 2 Aufl., B. 6, p. 588; Много сведений имеется также в жуоналах: «Ztschr. f. komprimierte u. fliissige Case», Weimar; «Ztschr. f. Kohlensaure», 1910—1914, c 1915 г. переименован в «Kohlensaure u. Mineralwasser», B.; «Ztschr. f. die gesamte Kalte-Industrie», В., C 1900 г. В, Янковский.