 > Техника, страница 87 > Углерод
> Техника, страница 87 > Углерод
Углерод
Углерод, С, химич. элемент IV группы пе-риодич. системы, ат, в 12,00, порядковый номер 6. До последнего времени У. считался не имеющим изотопов; лишь недавно удалось с помощью особо чувствительных методов обнаружить существование изотопа С13. У, —один из важнейших элементов по распространенности, по многочисленности и разнообразию его соединений, по биологическому значению (как органоген), по обширности технического использования самого У. и его соединений (как сырья и как источника энергии для промышленных и бытовых нужд) и наконец по своей роли в развитии химической науки. У. в свободном Состоянии обнаруживает ярко выраженное явление аллотропии (смотрите), известное уже более ГД, в·, но до сих пор не вполне изученное как по причине чрезвычайной трудности получения У. в химически чистом виде, так и потому, что большинство констант аллотропных модификаций У. сильно меняется в зависимости от морфологич. особенностей их структуры, обусловленных способом и условиями получения. У. образует две кристал-лич. формы—алмаз (смотрите) и графит (смотрите) и кроме того известен в аморфном состоянии в виде т. н. аморфного угля. Индивидуальность последнего в результате недавних исследований оспаривалась: уголь отождествляли с графитом, рассматривая тот и другой как морфологич. разновидности одной формы—«черного углерода», а разницу в их свойствах объясняли фи-зич. структурой и степенью дисперсности вещества. Однако в самое последнее время получены факты, подтверждающие существование угля как особой аллотропной формы (смотрите ниже).
Природные источники изапасыУ. По распространенности в нрироде У. занимает среди элементов 10-е место, составляя 0,013% атмосферы, 0,0025% гидросферы и ок. 0,35% всей массы земной коры. Большая часть У. находится в форме кислородных соединений: в атмосферном воздухе содержится ~ 800 млрд, m У. в виде двуокиси С02; в воде океанов и морей—до 50 000 млрд, m У. в виде С02, иона угольной кислоты и бикарбонатов; в горных породах—нерастворимые карбонаты (кальция, магния и других металлов), причем на долю одного СаС03 приходится - 160 · 10е млрд, т углерода. Эти колоссальные запасы не представляют однако энергетической ценности; гораздо более ценными являются горючие углеродистые материалы—ископаемые угли (смотрите), торф (смотрите), затем нефть, углеводородные газы и другие природные битумы (смотрите). Запас этих веществ в земной коре также довольно значителен: общая масса У. в ископаемых углях достигает - 6 000 млрд, т, в нефти ~ 10 млрд, т и т. д. В свободном состоянии У. встречается довольно редко (алмаз и часть вещества графитов). Ископаемые угли почти или вовсе не содержат свободного У.: они состоят гл. обр. из высокомолекулярных (полициклических) и весьма устойчивых соединений У. с другими элементами (Н, О, N, S), еще очень мало изученных. Углеродистые соединения живой природы (биосферы земного шара), синтезируемые в растительных и животных клетках, отличаются чрезвычайным разнообразием свойств и количеств состава; наиболее распространенные в растительном мире вещества—клетчатка и лигнин— играют роль и в качестве энергетич. ресурсов (смотрите Дерево). У. сохраняет постоянство распределения в природе благодаря непрерывному круговороту, цикл которого слагается из синтеза сложных органич. веществ в растительных и животных клетках и из обратной дезагрегации этих веществ при их окислительном распаде (горение, гниение, дыхание), приводящем к образованию С03, которая вновь используется растениями для синтеза. Общая схема этого круговорота м. б. представлена в следующем виде:
--С02 <--Органич. кислоты и С02 «---
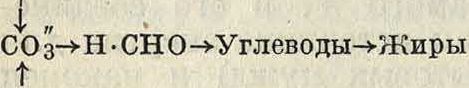
Горение топлива Карбонизация
--С02«---Уголь <—--
Получение У. Углеродистые соединения растительного и животного происхождения неустойчивы при высоких t° и, будучи подвергнуты нагреванию не ниже 150—400° без доступа воздуха, разлагаются, выделяя воду и летучие соединения У. и оставляя твердый нелетучий остаток, богатый углеродом и обычно называемый углем. Этот пиролитич. процесс носит название обугливания, или сухой перегонки, и широко применяется в технике: см. Дерево, сухая перегонка, Древесный уголь, Животный уголь. Высокотемпературный пиролиз ископаемых углей, нефти и торфа (при £°450—1 150°) приводит к выделению У. в графитообразной форме (кокс, ретортный уголь); о технологии этого процесса—см. Коксование, Кокс, Каменный уголь, сухая перегонка, Газ нефтяной и Торф. Чем выше t° обугливания исходных материалов, тем получаемый уголь или кокс ближе по составу к свободному У., а по свойствам—к графиту. Аморфный же уголь, образующийся при t° ниже 800°, не м. б. рассматриваем как свободный У., ибо содержит значительные количества химически связанных других элементов, гл. обр. водорода и кислорода. Из технич. продуктов к аморфному углю наиболее близки по свойствам активированный уголь (смотрите) и сажа (смотрите). Наиболее чистый уголь м. б. получен обу гливанием чистого сахара или пиперонала, специальной обработкой газовой сажи и тому подобное. Искусственный графит, полученный электротермии. путем, по составу представляет собою почти чистый У. Природный графит всегда бывает загрязнен минеральными примесями и кроме того содержит нек-рое количество связанных Н и О; в относительно чистом состоянии он м. б. получен лишь после ряда специальных обработок: механич. обогащения, промывки, обработки окислителями и прокаливания при высокой t° до полного удаления летучих веществ. В технологии У. никогда не имеют дела с совершенно чистым У.; это относится не только к натуральному углеродному сырью, но и к продуктам его обогащения, облагораживания и термич. разложения (пиролиза). Ниже приведено содержание У. в нек-рых углеродистых материалах (в %):
Костяной уголь. 6—12 Иромышл. актив-
Торф (сухой). 40—50 ные угли. 80—99
Почвенный гумус Графит природ-
(сухой). <-> 70 ный. 40—98
Бурые угли. 45—70 Графит, обогащен-
Каменные угли. 70—90 ный и прокален. 98,0—99,8
Антрацит. 90—95 Графит ачесонов-
Кокс металлурги- ский искусств. 99,8
ческий. 70—92 Наиболее чистый
Древесный уголь. 70—98 уголь лаборат.
Сажа. 80—95 изготовления. 99,8
Кровяной уголь. 88—91 Алмаз. 99,80—99,95
Физические свойства У. Свободный У. практически соверщенно неплавок, нелетуч и при обыкновенной t° нерастворим ни в одном из известных растворителей. Он растворяется только в нек-рых расплавленных мет, особенно при t°, приближающихся к t°KUпоследних: в железе (до 5%), серебре (до 6%), рутении (до 4%), кобальте, никеле, золотей платине. При отсутствии кислорода У. является наиболее жароупорным материалом; жидкое состояние для чистого У. неизвестно, а превращение его в пар начинается лишь при t° выше 3 000°. Поэтому определение свойств У. производилось исключительно для твердого агрегатного состояния. Из модификаций У. алмаз обладает наиболее постояннымифизич. свойствами; свойства графита в различных его образцах (даже .наиболее чистых) значительно варьируют; еще более непостоянны свойства аморфного угля. Важнейшие физич. константы различных модификаций У. сопоставлены в таблице. Алмаз—типичный диэлектрик, в то время как графит и уголь обладают металлич. электропроводностью. По абсолютной величине проводимость их меняется в очень широких пределах, но для углей она всегда ниже, чем для графитов; у графитов же приближается к проводимости настоящих металлов. Теплоемкость всех модификаций У. при t° > 1 000° стремится к постоянному значению 0,47. При t° ниже — 180° теплоемкость алмаза становится исчезающе малой и при —27° она практически делается равной нулю.
Химические свойства У. При нагревании выше 1 000° как алмаз, так и уголь постепенно превращаются в графит, который поэтому следует рассматривать как наиболее устойчивую (в условиях высоких температур) ионотропную форму У. Превращение аморфного угля в графит начинается повидимому ок. 800° и заканчивается при 1100° (в этой последней точке уголь теряет свою адсорбционную активность и способность к реактивации, а электропроводность его резко возрастает, оставаясь в дальнейшем почти постоянной).
Для свободного У. характерна инертность при обычных £° и значительная активность—при высоких. Наиболее активен в химии, отноше нии аморфный уголь, в то время как алмаз обладает наибольшей резистентностью. Так например, фтор реагирует с углем при <° 15°, с графитом же лишь при 500°, а с алмазом при 700°. При нагревании на воздухе пористый уголь начинает окисляться ниже 100°, графит ок. 650°, алмаз же выше 800°. При <° 300° и выше уголь соединяется с серой в сероуглерод CS2. При t° выше 1 800° У. (уголь) начинает взаимодействовать с азотом, образуя (в незначительных количествах) дициан C2N2. Взаимодействие У. с водородом начинается при 1 200°, причем в интервале ί° 1 200—1 500° образуется только метан СН4; выше 1 500°—смесь метана, этилена (С2Н4) и ацетилена (С2Н2); при t° порядка 3 000° получается почти исключительно ацетилен. При t° злектрич. дуги У. вступает в прямое соединение с металлами, кремнием и бором, образуя соответствующие карбиды. Прямыми или косвенными путями м. б. получены соединения У. со всеми известными элементами, кроме газов нулевой группы. У.—элемент неметаллич. характера, проявляющий нек-рые признаки амфотерности. Атом У. имеет диам. 1,50 А (1А=10”*cj№) и содержит во внешней сфере 4 валентных электрона, которые с равной легкостью отдаются либо дополняются до 8; поэтому нормальная валентность У. как кислородная, так и водородная равна четырем. В подавляющем большинстве своих соединений У. четырехвалентен; лишь в незначительном числе известны соединения двувалентного У. (окись У. и ее ацетали, изонитрилы, гремучая к-та и ее соли) и трехвалентного (т. н. «свободный радикал», см. Радикалы).
С кислородом У. образует два нормальных окисла.: двуокись углерода С02 кислотного характера (смотрите Углекислота) и нейтральную окись углерода (смотрите) СО. Кроме того существует ряд недокисей углерода, со держащих более 1 атома С, не имеющих тех-нич. значения; из них наиболее известна недокись состава С302 (газ с £JMn. +7° и („л. —111°).
Первым продуктом горения У. и его соединений является С02, образующаяся по ур-ию: C-f02=C02 -}-97 goo cal.
Образование СО при неполном сгорании топлива есть результат вторичного восстановительного процесса; восстановителем в этом случае служит сам У., к-рый при t° выше 450° реагирует с С02 по ур-ию:
С02+С=2С0 -38 800 cal;
реакция эта обратима; выше 950° превращение С02 в СО делается практически полным, что и осуществляется в газогенераторных печах. Энергичная восстановительная способность У. при высоких ί° используется также при получении водяного газа (Н20 + С== СО + Н2 — 28 380 cal) и в металлургии, процессах—для получения свободного металла из его окисла. К действию некоторых окислителей аллотропные формы У. относятся различно: например смесь KC103 + HN03 на алмаз совершенно не действует, аморфный уголь окисляется ей сполна в С02, графит же дает соединения ароматич. ряда—графитовые кислоты с эмпирич. формулой (Π,ΟΗ)^ и далее меллиТовую кислоту С„(СООН)в. Соединения У. с водородом—углеводороды (смотрите)—крайне многочисленны; от них генетически производится большинство остальных органических соединений (смотрите), в которые кроме У. входят чаще всего Η, О, N, S и галоиды.
Исключительное многообразие органич. соединений которых известно до 2 млн., обусловлено нек-рыми особенностями У. как элемента. 1) Для У. характерна прочность химия, связи с большинством остальных элементов как металлич., так и неметаллич. характера, благодаря чему он образует достаточно устойчивые соединения и с теми и с другими. Вступая в сочетание с другими элементами, У. весьма мало склонен к образованию ионов. Бблыная часть органич. соединений—го-меополярного типа и в обычных условиях не диссоциирует; разрыв внутримолекулярных связей в них нередко требует затраты значительного количества энергии. При суждении о прочности связей следует однако различать: а) прочность связи абсолютную, измеряемую термохимия. путем, и б) способность связи разрываться под действием различных реагентов; эти две характеристики далеко не всегда совпадают. 2) Атомы У. с исключительной легкостью связываются друг с другом (неполярно), образуя углеродные цепи, открытые или замкнутые. Длина таких цепей повидимому не подвержена никаким ограничениям: так, известны вполне устойчивые молекулы с открытыми цепями из 64 атомов У. Удлинение и усложнение открытых цепей не отражается на прочности связи их звеньев между собою или с другими элементами. Среди замкнутых цепей наиболее легко образуются 6- и 5-членные кольца, хотя известны кольчатые цепи, содержащие от 3 до 18 углеродных атомов. Способность атомов У. к взаимному соединению хорошо объясняет особые свойства графита (смотрите ниже) и механизм процессов обугливания; она делает понятным и тот факт, что У. неизвестен в форме двухатомных молекул С2, чего можно было бы ожидать по аналогии с другими легкими неметаллическими элементами (в парообразной фоцме углерод состоит из одноатомных молекул). 3) Благодаря неполярному характеру связей очень многие соединения У. обладают химия, инертностью не только внешней (медленность реагирования), но и внутренней
Физические свойства свободного углерода.
| Константы | Модификации | У. | |
| Алмаз | Графит | Аморфный уголь | |
| Кристаллич. форма.. | Кубич. сист. | Гексаген. сист. | Аморфен |
| Цвет | Бесцветный | Блест.-серый | Черный |
| Уд. вес
То же—средний для наиболее чис- |
3,51—3,52 | 2,22—3,32 | 1,4—2,0 |
| тых препаратов (П^°).. | 3,514 | 2,255 (а) | 1,72—1,86 |
| Атомный объём.. | 3,42 | 5,33 (среди.) | 6,5 (среднее) |
| Твердость по шкале Носа. | 10 | 5.5 | Переменная |
| Сжимаемость (ем2 кг~1).
Уд. электрпч. сопротивление при |
0,18-10-6 | -•3-10-6 | |
| 0° (QJcm).. | ^2-1014 | (2,64-35)-10-4 | Переменное |
| Коэф. преломления света. | 2,1178 (ДЛЯ Я = | 1,9—2,0 | — |
| Теплоемкость при +10°: | =5 890 а) | (ДЛЯ А =4 360ч-6 230 А) | |
| удельная (cai/г).. | 0,1128 | 0,1604 | Среди. 0,1935 (0,17—0,26) |
| атомная (са1/г-атом). | 1,35 | 1,92 | Среди. 2,32 (2,0—3,1) |
| i° перехода аллотропных форм. | Выше 1 000°—> -> графит | α->β при 570° | Выше
800—1 100°-» —>гря фит |
| -> графит | 3 845° К (?) | ->графит | |
| ί кип. | — | 4 200—4 830° | — |
| 4° возгорания (в чистом 02). | 800—900° | ~700° | 300—400° |
| Теплота горения (cal/г). | 7 869—7 873 | 7 832 -7 856
(*) (β) |
7 894—8 148 |
| » » (Са1/г-атом). | 94,48 | 93,97—91.27
(а) (β) |
97,65—97,78 |
(затрудненность внутримолекулярных перегруппировок). Наличие больших «пассивных сопротивлений» сильно затрудняет самопроизвольное превращение неустойчивых форм в устойчивые, часто сводя скорость такого превращения к нулю. Результатом этого является возможность реализации большого числа изомерных форм, практически одинаково устойчивых при обыкновенной ί°.
Аллотропия и атомная структураУ. Рентгенография, анализ дал возможность с достоверностью установить атомную структуру алмаза и графита. Этот же метод исследования пролил свет и на вопрос о существовании третьей аллотропной модификации У., являющийся по сути дела вопросом об аморфности или кристалличности угля: если уголь—аморфное образование, то он не м. б. отождествлен ни с графитом ни с алмазом, а должен рассматриваться как особая форма У., как индивидуальное простое вещество. В алмазе атомы У. размещены т. о., что каждый атом лежит в центре тетраэдра, вершинами которого являются 4 смешных атома; каждый из последних в свою очередь является центром другого такого же тетраэдра; расстояния между смежными атомами равны 1,54 А (ребро0 элементарного куба кристаллич. решетки равно 3,55 А). Такая структура является наиболее компактной; * ей соответствуют высокая твердость, плотность и химия, инертность алмаза (равномерное распределение валентных сил). Взаимная связь атомов У. в решетке алмаза такая же, как и в молекулах большинства органических соединений жирного ряда (тетраэдрическая модель У.—см. Асимметрический углерод). В крист графита атомы У. расположены плотными слоями, отстоящими один от другого на 3,35—3,41 А; направление этих слоев совпадает с плоскостями спайности и плоскостями скольжения при механич. деформациях. В плоскости каждого слоя атомы образуют сетку с шестиугольными ячейками (,соты); сторона такого шестиугольника равна 1,42—1,45 А. В смежных слоях шестиугольники не лежат один под другим: совпадение их по вертикали повторяется лишь через 2 слоя в третьем. Три связи каждого атома У. лежат в одной плоскости, образуя углы в 120°; 4-я связь направлена попеременно в ту или другую сторону от плоскости к атомам соседних слоев. Расстояния между атомами в слое строго постоянны, расстояние же между отдельными слоями м. б. изменено внешними воздействиями: так, при прессовании под давлением до 5 000 atm оно уменьшается до 2,9 А, а при набухании графита в конц. HN03—увеличивается до 8 А. В плоскости одного слоя атомы У. связаны гомеополярно (как в углеводородных цепях), связи же между атомами смежных слоев имеют скорее металлический характер; это видно из того, что электропроводность кристаллов графита в направлении, перпендикулярном к слоям, в —100 раз превышает проводимость по направлению слоя. Т. о. графит обладает свойствами металла в одном направлении и свойствами неметалла—в другом. Расположение атомов У. в каждом слое решетки графита совершенно такое же, как .в молекулах слошноядерных ароматических соединений. Такая конфигурация хорошо объясняет резкую анизотропность графита, исключительно развитую спайность, антифрикционные свойства и образование ароматических соединений при его окислении. Аморфная модификация черного углерода повидимому существует как самостоятельная форма (О. Руфф). Для нее наиболее вероятным является пенообразное ячеистое строение, лишенное всякой правильности; стенки таких ячеек образованы слоями активных атомов У. толщиною примерно в 3 атома. На практике активная субстанция угля залегает обычно под оболочкой из тесно расположенных неактивных атомов У., ориентированных графитообразно, и пронизана включениями очень мелких графитовых кристаллитов. Определенной точки превращения уголь->графит вероятно не имеется: между обеими модификациями осуществляется непрерывный переход, на протяжении которого происходит перестроение беспорядочно скученной массы С-атомов аморфного угля в правильную кристаллическую решетку графита. В силу своего беспорядочного расположения атомы У. в аморфном угле проявляют максимум остаточного сродства, что (согласно представлениям Лангмюира о тождественности адсорбционных сил с силами валентными) соответствует столь характерной для угля высокой адсорбционной и каталитич. активности. Атомы У., ориентированные в кристаллич. решетку, затрачивают на взаимное сцепление все свое сродство (в алмазе) или большую часть его (в графите); этому соответствует понижение химич. активности и активности адсорбционной. У алмаза адсорбция возможна лишь на поверхности монокристалла, у графита же остаточная валентность может проявляться на обеих поверхностях каждой плоской решетки (в «щелях» между слоями атомов), что и подтверждается фактом способности графита к набуханию в жидкостях (HN03) и механизмом его окисления в графитовую к-ту.
Техническое значение У. Об использовании естественных видов углеродного сырья и топлива (природных углей, нефти, древесины, торфа, жиров, графита и т. д.) и продуктов их переработки—см. соответствующие статьи. Что касается б. или м. свободного У., получаемого при процессах обугливания и коксования, то его применение в технике основывается как на химич. (инертность, восстановительная способность), так и на физич. его свойствах (жаростойкость, электропроводность, адсорбционная способность). Так, кокс и древесный уголь, помимо частичной прямой утилизации их в качестве беспламенного топлива, используются для получения газообразного горючего (генераторных газов); в металлургии черных и цветных металлов—для восстановления металлич. окислов (Fe, Си, Zn, Ni, Сг, Μη, W, Mo, Sn, As, Sb, Bi); в химич. технологии— как восстановитель при получении сульфидов (Na, Са, Ва) из сульфатов, безводных хлористых солей (Mg, А1), из окисей металлов, при производстве растворимого стекла и фосфора— как сырье для получения карбида кальция,-карборунда и других карбидов сероуглерода и т. д.; в строительном деле—как термоизолирующий материал. Ретортный уголь и кокс служат материалом для электродов электрич. печей, электролитич. ванн и гальванич. элементов, для изготовления дуговых углей, реостатов, коллекторных щеток, плавильных тиглей ит. п. а также в качестве насадки в химич. аппаратуре башенного типа. Древесный уголь кроме указанных выше применений идет для получения концентрированной Окиси углерода, цианистых солей, для цементации стали, широко используется как адсорбент (смотрите Активированный уголь и Рекуперация), как катализатор для нек-рых синтетич. реакций, наконец входит в состав дымного а и других чатых и пиротехнич. составов.
Аналитическое определение У. Качественно У. определяется обугливанием пробы вещества без доступа воздуха (что пригодно далеко не для всех веществ) или, что гораздо надежнее, исчерпывающим окислением его, например прокаливанием в смеси с окисью меди, причем образование С02 доказывается обычными реакциями. Для количественного определения У. навеска вещества подвергается сожжению в атмосфере кислорода (об аппаратуре и методике см. Анализ химический); образующаяся СО2 улавливается раствором щелочи и определяется весовым или объёмным путем по обычным методам колич. анализа. Этот способ годен для определения У. не только в органич. соединениях и технич. углях, но также и в мет.
Лит.: Менделеев Д., Основы химии, 9 изд., т. 1, М.—Л., 1927; Мен шутки и Б., Курс общей химии (неорганической), 4 изд., Л., 1933; Эфраим Ф., Неорганич. химия, пер. с нем., ч. 1, Л., 1932; Donatu E. и. Poliak К., Neuerurigen in der Chemie des Ivoh-lenstoffes u. seiner anorganischen Verbindungen (Samml. chemischer u. chemiseh-technischer Vortrage, lirsg. v. H. Herz), B. 3, H. 4, Stg., 1898; Ullm. Enz., 2 Aufl., B. 6, p. 605,; E p b г a i m Er., Anorganische Chemie, 4 Aufl. Dresden—Lpz., 1929; van’t Hoff J., Ansichten liber die organische Chemie, B. 2, 1881; H e nrl ch F., Theorien d. organischen Chemie, 5 Aufl., Brschw., 1924; H fl-ctelW, Theoretische Grundlagen d. organischen Chemie, B. i u. 2, Lpz., 1931; Oswald M., «Chimie et Industrie», P., 1 930, 1. 24, p. 280. В. Янковский.