 > Техника, страница 87 > Уксусная кислота
> Техника, страница 87 > Уксусная кислота
Уксусная кислота
Уксусная кислота, CH3-COOH, бесцветная жидкость с острым запахом. Безводная, так называемая ледяная, У. к. замерзает при 16,55—16,6°; водные растворы замерзают при более низких темп-pax (табл. 1). При плав-
Т а б л. 1.-гТемпературы замерзания водных растворов У. к.
| % | « | % | t° |
| 96 | 10,17 | 99,2 | 15,12 |
| 93,5 | 10,99 | 99,4
99,6 |
15,47 |
| 97 | 11,81 | 15,84 | |
| 97,5 | 12,52 | 99,8 | 16,28 |
| 98 | 18,25 | 99,9 | 13,51 |
| 98,5
99,0 |
14,01
14,80 |
100 | 16,75 |
лении ледяной У. к. объём возрастает в 1,16 раза; теплота плавления 46,4 cal/г; t°m„, .118,1°; теплота испарения 84 cal/г при 20° к
97,05 cal/г при t°Kun. Состав пара при кипении водных растворов У. к. различных концентраций см. табл. 2. Уд. в чистой безводной У. к.
Т а б л. 2.—К и п е н и е смеси У. к.—вода при 760 миллиметров.*
| t° | Мол. % | г | Мол. %. | ||
| В жидкости | в парах | В жидкости | в парах | ||
| 100 | 0 | 0 | 104,33 | 50 | 31,0 |
| 100,5 | 10 | 6,3 | 105,78 | 60 | 43,0 |
| 101,18 | 20 | 12,2 | 108,95 | 75 | 60,0 |
| 102,05 | 30 | 18,5 | 111,85 | 85 | 73,8 |
| 103,15 | 40 | 26,0 | 118,10 | 100 | 100 |
* Поварнин — Марков.
1,0553; уд. в водных растворов У. к. возрастают по мере повышения концентрации, достигают максимума при содержании 77—80% У. к. (уд. в 1,0748) и затем вновь падают. Средняя теплоемкость для жидкой У. к. 0,5265, для паров 0,4008; t°Kpum. 321,5°. У. к. принадлежит к числу слабых электролитов. Константа диссоциации 1I1N водного раствора У. к. при 18° &=1,82-КГ5. Молекулы У. к. в водных растворах в значительной степени ассоциированы, в парах—менее ассоциированы.
Получение У. к. Важнейшие способы производства У. к.: 1) лесохимии., 2) синтетич. и 3) окисление этилового а в присутствии бактерий. 1. Лесохимический способ. По этому способу У. к. получается при сухой перегонке дерева (смотрите Дерево, сухая перегонка) и сгущается вместе с летучими смолами, образуя «подсмольную воду». Из последней после отстаивания от смолы получают метиловый и У. к.
Добывание У. к. и метилового а из хвойных пород невыгодно. Поэтому на Урале, где леса состоят на 95% из хвойных пород, несмотря на большие размеры углежжения е целью выплавки чугуна подсмольные воды не использовались. Такое же явление наблюдает-
ся в Швеции. Добывание У. к. из «древесной жижки», получаемой при сухой перегонке, сводилось до недавнего времени к получению из жижки древесного порошка с тем или иным содержанием уксуснокислого кальция. За границей этот метод почти изжит, вместо него применяются новые, более рентабельные методы—экстракционные. В СССР до последнего времени У. к. получалась через древесный порошок, и только в 1932 г. построены з-ды Ашинский и Сявский по получению У. к. из жижки экстракционным методом.
Древесный порошок получается из жижки сл. обр. (смотрите Дерево, сухая перегонка): в медном кубе жижка обогревается паром, и пары ее поступают последовательно в другие кубы с известковым молоком. В этих кубах У. к. связывается, образуя раствор ацетата кальция, к-рый выпаривается затем досуха в чренах, а проскакивающие пары ацетона и метилового а поступают в холодильник и конденсируются. Обычный серый порошок содержит 80— 82% уксуснокислого кальция, 4% влаги, 10% кристаллизационной воды и 4% неорганич. и органич. примесей. Вырабатываемый на нек-рых наших з-дах черный порошок содержит 59—61% ацетата кальция. Уксусный порошок разлагается потом в чугунных котлах конц. к-тами—серной или соляной. Отсюда отгоняется примерно 70%-ная У. к., которая подвергается затем ректификации в колоннах для получения ледяной У. к. Указанный способ получения У. к. дорог и страдает серьезными недостатками, т. к. его применение связано с большими затратами тепла на выпаривание уксуснокислого кальция, на разложение порошка, на концентрирование слабых погонов У. к., получающихся при ректификации, и с расходованием минеральных к-т. Только новые методы экстракции У. к. непосредственно из подсмольной воды спасли лесохимии, метод от полного вырождения перед лицом сильного конкурента—синтетического метода.
Экстракционные методы заключаются в том, что жижка подвергается обработке растворителями, извлекающими У. к., причем растворитель регенерируется. По методу Брюстера жижка обрабатывается на холоду легкими растворителями: этиловым эфиром (t°Kun. 34,Ь°) или уксусноэтиловым эфиром (Г*мге. 77°) [’]. После экстракции растворитель отгоняется, и получается 70—75%-ная У. к. Смешение жижки "и растворителя производится в высоких колоннах (20—25 м), наполненных кольцами Рашига или другой насадкой. Целесообразно вести процесс экстракции по принципу противотока; установка для этой цели состоит из батареи смесителей: в первый смеситель поступает растворитель, а в последний— жижка, которая последовательно проводится через ряд смесителей. Обедневшая жижка встречается в первом смесителе со свежим растворителем, где экстрагируются последние остатки кислоты. Для уменьшения растворимости воды в растворителе к последнему прибавляют углеводороды. Недостатком метода является потеря части растворителя вследствие его растворения в воде. Метод Брюстера применяется в Европе и США; этот же метод применяется на наших з-дах Сявском и Ашинском.
По методу Сюида в отличие от метода Брюстера применяются высококипящие растворители—крезол, смоляные масла, не растворяющиеся в воде [2].В последнем усовершен ствованном варианте [3] экстракция У. к. производится не на холоду, а из паров жижки по принципу противотока. Растворяются только пары У. к. и не растворяются пары воды и метанола. У. к. отгоняется в вакууме в виде ледяной У. к., и растворитель возвращается в процесс. По методу Сюида работают установки в Германии, Франции, Югославии и в Америке. Из экстракционных методов способ Сюида наиболее рентабелен и технически разработан
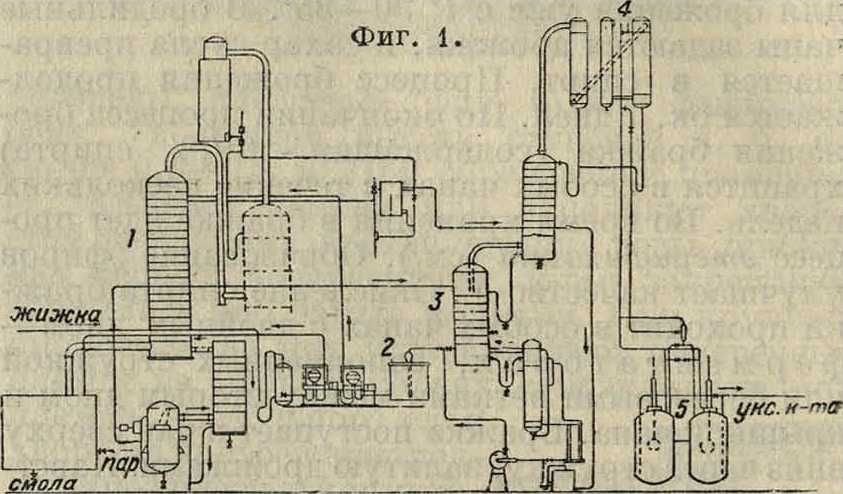
(смотрите фигура 1, где 1—колонка, куда подаются пары жижки, из 2 подается растворитель, 3—колонка для отгонки У. к. в вакууме, 4—вакуум-насосы, 5—приемник).
2. Синтетический способ заключа- ется в окислении ацетальдегида воздухом или кислородом:
КСН3-СН0+*0г=СН3-С00Н.
Ацетальдегид (смотрите) производится в больших масштабах синтетически из ацетилена по методу Кучерова:
СН:СН+Н20=СН3.СН0,
а также из этилового а по одному из двух контактных способов:
СНа-СН2ОН=СН3-СНО+Н2,
сн3-сн2он+| о2=сн3-сно+н2о.
Механизм окисления ацетальдегида в присутствии катализаторов не изучен: установлен факт, что при окислении в отсутствии катализаторов образуется перу к су сна я к-т а: сн3-сно+о2=сн3-сооон.
Среди различных катализаторов (солей Fe, Μη, Ni, Со, Сг), ускоряющих реакцию окисления ацетальдегида, особенно следует отметить соли Мп, в присутствии которых не происходит образования заметных количеств перук-сусной кислоты и окисление протекает исключительно быстро. Большинство современных заводов применяет в качестве катализатора для получения У. к. ацетат Мп [4]. Наиболее активным катализатором является азотнокислый Мп Р]. Окисление ацетальдегида в У. к. в заводском масштабе производится по двум способам: 1) перио- дическомуи2) непрерывному. До последнего времени наибольшее количество синтетич. У. к. производится по первому способу. Крупнейшие установки имеются в Канаде и в Германии.
| 6 | lit ^ |
| п | л Ши. |
| »1 | |
| !6 | ж |
| 13 |
Фигура 2.
Описание важнейших типов окислительных аппаратов периодич. действия см. [®].
Схема окислительного аппарата Канадской компании показана на фигуре 2: 1 — змеевик для охлаждения; 2—малый змеевик для нагревания; 3—впуск пара; 4—впуск воды через 5 в змеевик 2; 6—впуск воды в змеевик 1; 7—выход воды из змеевика 1; 8—выход ее из 2; 9— впуск ацетальдегида; 10—выход азота; 11—· подача катализатора; 12—кран для взятия пробы; 13—труба для впуска воздуха; 14, 15, 16—· манометры; 17—холодильник для крышки; 18— спускной кран; 19—термометр. Реакционный котел сделан из железа с алюминиевой футеровкой толщ. 5 миллиметров; диам. 1,65 м; высота 3,3 м; 2 алюминиевых холодильника служат для охлаждения реагирующей массы. Воздух подается через барботер, находящийся на дне сосуда. Чистый 99,8%-ный альдегид, хранящийся при 0—5°, подается в котел в количестве 4 500 килограмм. Катализатор (ацетат марганца), растворенный в У. к., подается в количестве 18— 22 килограмма; затем подают немного воздуха и впускают в один из змеевиков пар для разогрева. Когда реакция начинается, впуск пара прекращают и затем регулируют <° охлаждающими змеевиками, доводя ее в течение 4 час. до 60°. Давление не превышает 5 atm., Реакция длится 14 час. Выходящий
У. к. получается 90—92%-ная и после дистилляции доводится до 99%-ной. До 75% загруженного альдегида превращается в У. к.; 15% уносится с током азота; ок. 10% тратится на побочные реакции.
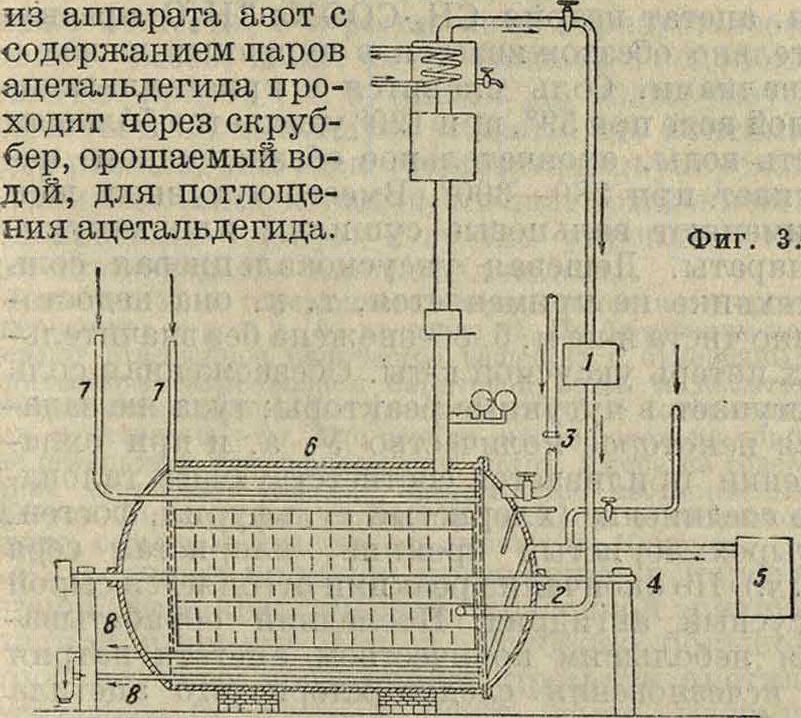
На германских заводах употребляют меша-лочные аппараты. Р1а фигура 3 дан окислительный аппарат фирмы Meister Lucius Farbwer-ke (1—компрессор для подачи кислорода по трубе 2; 3—впуск ацетальдегида; 4—труба для вывода конечных продуктов в сборник 5; 6— алюминиевые холодильники; 7—впуск охлаждающей воды; 8—выход воды). Особенностью аппарата является алюминиевая мешалка, похожая на водяное колесо. Окисление производится кислородом при 2 atm. Одновременно в таком аппарате окисляется 1,5 тонн ацетальдегида. В описанных выше аппаратах одновременно загружается в окислительные аппараты большое количество альдегида, вследствие чего нужны особые предосторожности для избежания а, могущего произойти от образования перуксусной к-ты. Окислительный аппарат Griesheim Elektron построен в связи с этим иначе. В нем окисляется одновременно только 20 л ацетальдегида, после окисления которых впускают новую порцию, и так повторяют эту операцию до 20 раз, после чего охлаждают аппарат и сливают У. к. Аппарат для непрерывного окисления ацетальдегида [7] представляет собой алюминиевую колонну с насадкой. Альдегид, растворенный в У. к., циркулирует по колонне, и навстречу ему подается кислород или воздух. Теплота реакции отводится путем охлаждения водой (наружная рубашка). В нижней части колонны производится подогрев стекающей уксусной кислоты для разрушения перуксусной кислоты. Колонные аппараты спроектированы в СССР Укрхим-проектом (М. Ковалев) и Институтом им. Карпова (Каган и Морозов) на основании собственных исследований.
3. Способ окисления а путем брожения см. Уксус.
Применение У. к. У. к. находит широкое применение в быту и технике. В виде разбавленных водных растворов она употребляется в пищевых целях под названием уксуса (смотрите). В технике она употребляется в качестве сырья; в химич. пром-сти—для получения сложных эфиров (смотрите Эфиры сложные), для получения уксусного ангидрида (смотрите), применяющегося вместе с У. к. для производства ацетилцеллюлозы (смотрите Волокно искусственное), и для получения по контактному способу ацетона; в текстильной пром-сти—для получения протрав и аппретурных средств; в фармацевтич. пром-сти—для получения различных продуктов и полупродуктов (хлоруксусной к-ты, ацетина, аспирина, антипирина, фенацетина, ванилина и т. д.); в красочной пром-сти (синтез индиго и др.); в лакокрасочной (свинцовые белила и др.) и в других областях пром-сти.
Мировое производство У. к. приблизительно оценивается в 80 000 тонн Производство синтетической уксусной кислоты в СССР—вопрос ближайшего будущего.
Лит.: 1)Ан.П. 187603/1922; Канад. П. 247385/1925; 2) Ан. П. 255047; Ф. П. 618954; ») Ф. П. 639112; Ам. П. 1624812/1920 и др. J) Г. П. 305550/1914 Consortium fur elektrochem. Ind.; 6) Сов. Π. 84374 (1931); Каган Μ. и Морозов Н., Каталитич. получение ледяной уксусной кислоты из ацетальдегида, «Ж. прикл. хим.», 1932, т. 5, стр. 400; s) D е с h 1 e n s, «Chimie et industrie», P., 1921, t. 5, p. 239, 398, 528 (обзор промышлен. методов получения ацетальдегида из ацетилена и синтетич. уксусной к-ты); швед. П. 106776, см. «Chem. Ztrbl.», 1925, и, р. 763; Ковалев М., Синтетическая уксусная кислота, Харьков, 1933; Bunbury Н., Die trok-kene Destination des Hoizes, В., 1925; В u g g e О., Die Industrie der Holzdestillationsprodukte, Dresden—Lpz., 1927; M i g η ο n a c, «Bull. Soc. chimique de France», Paris, 1921, 4 sirie, t. 29, p. 465; Ullm. Enz., 2 Auf-lage, B. 4, p. 641—665 (там же с патентной литературы). См. также лит. к ст. Дерево, сухая перегонка. М. Наган.
Ацетаты, уксуснокислые соли и эфиры уксусной кислоты. Соли У. к. существуют средние и основные; средние соли отвечают формуле СН3СООМе, где Me—одновалентный металл. Щелочные и щелочноземельные металлы дают средние соли; металлы большей валентности дают б. ч. основные соли. Соли У. к. легко кристаллизуются; средние соли б. ч. легко растворяются в воде; в разбавленных растворах щелочные соли нацело диссоциированы. Растворы солей слабых оснований (Fe и А1) при выпаривании и кипячении распадаются полностью на окись металла и свободную кислоту. Сильные минеральные к-ты, а также нелетучие органич. кислоты вытесняют У. к. из ее солей. Получают соли растворением окисей металлов или гидратов окисей, или карбонатов в раз бавленной У. к. или при помощи двойного разложения уксуснокислых солей с соответственными сульфатами. Безводные соли можно также получать из зфиров У. к. Ацетат натрия NaC2H302-3H20, бесцветные и без запаха моноклинные кристаллы горько-соленого вкуса; растворяется в воде со слабо щелочной реага. ней при 6° в 3,9 ч., при 100° в 0,5 ч. воды, в е—при обыкновенной 4° в 23 ч. и при кипячении в 1 ч.; при нагревании (до 75°) плавится в своей кристаллизационной воде; при 120° вся кристаллизационная вода удаляется, и остается безводная соль—белый чешуйчатый порошок с уд. в 1,421, 4°ю, 319°; при сильном нагревании (410—450°) перегоняется смесь из 53% ацетона и 37% нерастворимого в воде маслянистого вещества; в осадке остаются сода и следы углерода. Приготовляют ацетат натрия из чистой У. к., нейтрализуя ее содой. Ацетат натрия находит применение в лабораторной практике для получения уксусного ангидрида и хлористого ацетила, в терапии— как лекарственное средство при катаре кишок и желудка, в пищевой пром-сти—для консервирования мяса, овощей и грибов. Безводная соль служит водуотнимающим средством при органич.синтезах.Двойная соль (с 1 мол. СаС12) находит применение в терапии. О свойствах и применении солей других металлов см. соответственные металлы.
Эфиры У. к. являются хорошими растворителями; о свойствах их и применении см. Растворители.
Хлорпроизводные У. к. Хлорук-с у с н а я к-т а, монохлоруксусная к-та, С1СН2 · •СООН, бесцветные, легко расплывающиеся кристаллы с 4°ял. 61°, 4°кви. 189,5°, 1Р4° 1,370; легко растворяется в воде, при кипячении распадается на гликолевую и соляную к-ты: С1СН2-С00Н + Н20=Н0СН2-С00Н + НС1.
Ее пары разрушают кожу, пробку и каучук; получают ее хлорированием У. к. в присутствии катализатора;
СН8-СООН + С12=С1СН2-СООН+НС1. Применяется она в производстве красителей (синтетическое индиго) и служит исходным материалом для получения веронала, гликоколя и гликолевой к-ты. Дихлоруксусная кислота С12СН-СООН, едкая жидкость, застывающая при 10,8°, t°mn. 194°. Получается в небольшом количестве при хлорировании У. к., а также из хлоральгидрата - кипячением с раствором цианистого калия; служит для приготовления нек-рых химич. препаратов и в медицине. Трихлоруксусная к-та СС13·
• СООН, легко растворяющиеся в воде кристаллы с острым запахом, <°„л. 57°, 4°1ШЯ. 196—197°, служит для приготовления хлороформа, является реактивом на белок. Хлористый ацетил, хлорангидрид У. к. СН3-СОС1, бесцветная остропахнущая жидкость с 4°кяя. 51,9°; служит для приготовления ацетофенона и для ацетилирования аМИНОВ И фенОЛОВ. Н. Ельцина.