 > Техника, страница 89 > Фенолы
> Техника, страница 89 > Фенолы
Фенолы
Фенолы, важнейший класс органических соединений, характеризуемый наличием гидроксильной группы, замещающей водород бензольного ядра. В зависимости от числа гидроксильных групп различают одноатомные и многоатомные фенолы. По своей распространенности, размерам и многообразию промышленного применения выдающееся место занимает простейший Ф.—С6Н6ОН, т. н. карболовая кислота. Он кристаллизуется в бесцветных иглах или призмах’ специфич. запаха; <°ил.
41,5—43°, t°3acn. 40,5—40,9°, t°Kun. 181,3° (при 760 миллиметров Hg). Dig—1,0722; теплота сгорания при постоянном давлении 768,76 Cal. На воздухе и на свету Ф. окрашивается в розовый цвет; примесь восстановителей, как SnCI2. препятствует окрашиванию, следы металлов, как Fe, Си, а также аммиак и некоторые производные ускоряют его. Контроль чистоты Ф. при приемках и в заводских лабораториях производится гл. обр. по определению t°3acm. и по растворимости в 15%-ном растворе NaOH. Влажность, притягиваемая фенолом из воздуха, значительно понижает t°,u, известен гидрат его СвН50Н-Н20 с ί°ΚΛ. 17,2°. С ббльшим количеством воды карболовая кислота образует при обыкновенной (° две несмешивающиеся жидкости—раствор фенола в воде и раствор воды в феноле. При 15° 100 ч. Ф. растворяют 37,4 ч. воды и 100 ч. воды растворяют 8,2 ч. фенола; при температурах выше 65° Ф. смешивается с водой во всех соотношениях. Фенол чрезвычайно легко растворим в е, серном эфире, бензоле, глицерине и ледяной уксусной кислоте, труднее в лигроине. Растворимость в щелочах основана на образовании солей—легко гидролизуемых фенолятов, разлагаемых углекислотой. С6Н5ОН является продуктом обмена веществ животного организма и встречается в небольших количествах в моче; он обнаружен также среди продуктов гниения белка. Ф. ядовит, особенно при нанесении на раны, свертывает белок и обладает значительным кожным действием. Смертельная доза при приеме внутрь не менее 8—10 г; как противоядие применяется сахарат кальция. Присутствие С6Н5ОИ обнаружено в остатках от перегонки нефти нек-рых месторождений, а также в сосновых шишках и иглах; Ф. образуется при многих пирогенетических процессах: при сухой перегонке дерева, бурого угля и каменного угля. Каменноугольная смола является основ,-ным сырьем для промышленного получения Ф. (смотрите Коксобензольное производство, переработка каменноугольной смолы). Смесь среднего масла с нек-рыми погонами легкого и тяжелого масел, перегоняющаяся в интервале 160-1-250°, содержит 25-1-40% Ф., гл. обр. С6Н5ОН; большая часть нафталина удаляется охлаждением; карболовое масло с-
t°mn. 160 4- 205°, содержащее 35 -1- 40% Ф., подвергается обработке раствором едкого натра, причем сперва растворяется СвН5ОН, а затем, при избытке щелочи,—крезолы (смотрите), на чем и основан один из методов отделения последних от СвНБОН. Пропусканием пара отгоняют из щелочной жидкости углеводороды и пиридиновые основания, пропускают через фильтрпрессы и осаждают С6Н6ОН углекислотой. Фракционированной перекристаллизацией получают чистую карболовую к-ту. Выход 0,3-1- 0,5% от веса каменноугольной смолы. Большое тех-нич. значение имеет также получение синтетич. С6Н6ОН путем сплавления бензосульфокисло-го натрия с едким натром:
C6H6S08Na+Na0H=CeH50H-fNa2S05.
Для получения бензосульфокислого натрия бензол сульфируют дымящей серной к-той при 50—70° в течение 30 ч. Продукт реакции нейтрализуют известковым молоком и фильтруют. Растворимая в воде кальциевая соль бен-аосульфокислоты обрабатывается раствором соды. После отделения карбоната кальция выпариванием получают натриевую соль с содержанием ок. 10% воды. Само сплавление с едким натром производят в железных котлах,
| Наименование индикатора | Продажные названия | Переход цвета | Границы pH |
| Тимолсульфофталеин (кислая обл.) | Тимоловый синий | Красный—желтый | 1,24-2,8 |
| Тетрабромфенолсульфофталеин | Бромфеноловый синий | Желтый—синий | 34-4,6 |
| Дибром-о-крезолеульфофталеин | Бромкрезоловый пурпурный | Желтый—пурпурный | 5,2ч-6,8 |
| Дибромтймолсульфофталеин | Бромтимоловый синий | Желтый—синий | — |
| Фенолсульфофталеин | Феноловый красный | Желтый—красный | 6,84—8,4 |
| о-Крезолсульфофталеин | Крезоловый красный | Желтый—красный | 7,24-8,8 |
| Тимолсульфофталеин (щелоч. обл.) | Тимоловый синий | Желтый—синий | 84-9,6 |
| 9-Крезол фталеин | Крезолфталеин | Бесцветный—красный | 8,24-9,8 |
снабженных мешалками, при 340°. Продукт реакции обрабатывается небольшим количеством воды для отделения более растворимого фенолята натрия от большой части сульфита (последний используется в технологии, процессе взамен соды для превращения кальциевой соли бензосульфокислоты в натриевую). Из раствора фенолята получают СвН5ОН пропусканием S02, С02 или прибавлением H2S04; очистку производят перегонкой. Выход чистого кристаллич. Ф. составляет 75-г-80% от веса исходного бензола. За последнее время получает распространение метод получения Ф. путем гидролиза хлорбензола 15—20%-ным раствором NaOH в течение 8 час. при t° ~ 300°. Из лабораторных способов получения различных Ф. важнейшим является диазотирование нитритом натрия соответствующих аминов и превращение образующихся водных растворов диазосоединений нагреванием в Ф., например для простейшего Ф.
C0H5-N2· Cl+H20=CeH5-0H+HCl+N2.
С6Н5ОН образуется также непосредственно из бензола при окислении воздухом или neper кисью водорода в присутствии катализаторов.
Характерной дляСвН5ОН является фиолетовая окраска с раствором хлорного железа. Наиболее же чувствительной реакцией для обнаружения следов Ф. является получение желтого осадка, дающего с HN03 красный раствор при нагревании с милоновым реактивом—раствором азотнокислой закиси ртути, содержащим продукты разложения азотистой к-ты, то есть нитрозные газы. Количественное определение Ф. производится обычно превращением его бромом in statu nascendi в трибромфенилбромид; последний выделяет из йодистого калия иод по ур-ию:
CeH2Br3OBr + 2KJ=C6H2Br3OK +КВг + 2J.
Выделившийся при этом иод оттитровывается раствором гипосульфита.
Ф. имеет широкое применение в анило-кра-сочной пром-сти для получения многих важнейших красителей. В производстве чатых веществ Ф. служит сырьем для получения пикриновой кислоты. В фармацевтич. пром-сти из фенола получают салициловую кислоту и ее производные (аспирин, салипирин, фен, л); Bi-соль трибромфенола находит широкое применение под названием ксероформа; Ф. служит сырьем для получения «-оксифенил-арсиновой к-ты—исходного продукта для получения сальварсана. Получаемый из Ф. сали-/ОН
циловый альдегид С6Н4 перерабатывает-хСНО
ся в ценное душистое вещество·—кумарин. Большое значение для парфюмерной пром-сти имеют также эфиры Ф., получаемые обычно действием соответствующих бромистых соединений на феноляты, например
С6Н5ОК+ВгС2Н5=С6Н5ОС2Н5+КВг.
Метиловый эфир СвН5ОСНз—анизол (смотрите); этиловый эфир—фенетол (смотрите). Дифениловый эфир 0(C6Hs)2 (t°mn, 252—259°, «°„. 27°) применяется как душистое вещество (запах герани). Общеизвестно применение фенолов для целей дезинфекции; однако вследствие своей ядовитости он постепенно вытесняется из этой области крезолами и специальными препаратами, например лизолом. Важнейшее значение имеет Ф. в производстве искусственных смол и пластич. масс. Наконец Ф. является сырьем для получения трифенилфосфата, широко применяющегося как смягчитель для нитролаков и как суррогат камфоры.
Высшие гомологи Ф. являются производными соответствующих углеводородов—а
(смотрите Крезолы), ксилола (смотрите Ксиленолы) и т. д., их физич. и химич. свойства весьма напоми-г нают Ф. Помимо крезолов технич. применение находит лишь тимол сн3
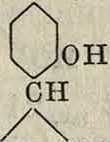
сн3 сн3
получаемый из эфирного масла (Thymiis serpyllum), как антисептик и в особенности как пропитка, предохраняющая от развития плесени. Изомерное соединение карвакрол сн.
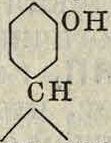
сн3 сн3
близко по структуре группе терпенов (смотрите) и м. б. получено из пулегона. Наличие гидроксильной группы в Ф. в значительной степени облегчает непосредственное введение в ядро нитро- и сульфогрупп, а также хлора и брома. Нитрофенолы и продукты их восстановления — аминофенолы, фенолсульфокислоты, галоидофенолы и производные этих соединений имеют значительное техническое применение; п-х лорфенол (Гил. 37°, t°Km. 217°) применяется как антисептик и служит для получения некоторых красителей типа хинизарина; о-х лорфенол (ί°„. 7°, t°Kun. 173—176°) служит для получения пирокатехина (смотрите) и применяется как средство борьбы с вредителями; 2, 4, 6-т р и б р о м ф е и о л (<°ил.95—96°) применяется как антисептик под названием б р о-м о л; w-нитрофенол (Гил. 113°) и соответствующее о-соединение (Гял. 44,5°) служат для получения сернистых красителей и для производства соответствующих метиловых и этиловых эфиров аминофенолов: анизидина (смотрите) и фене-тиоина (смотрите).
Многоатомны еФ. Наиболее важным синтетич. методом получения многоатомных Ф. является сплавление соответствующих многоатомных сульфокислот, а также галоидозамещенных и сульфокислот простейших Ф. с едкими щелочами. Многоатомные Ф. могут быть также получены окислением одноатомных Ф. или соответствующих ароматич. углеводородов при помощи перекиси водорода или персульфата калия. Нек-рые многоатомные Ф. и их производные получаются технически из естественных продуктов, например пирогаллол, флороглюцин, или образуются в результате пирогенетич. процессов. Для большинства многоатомных Ф. характерна чрезвычайно легкая окисляемость, особенно в щелочном растворе, на чем иногда основано их технич. применение, например пирогаллола—для определения кислорода в газовых смесях и как проявителя в фотографии, гидрохинона—как проявителя. С раствором хлорного железа многоатомные Ф·. дают характерные окрашивания. Важнейшими многоатомными Ф. и их производными,’ нашедшими применение в пром-сти, являются: пирокатехин (смотрите), гваякол (смотрите), пирогаллол (смотрите), резорцин (смотрите), гидрохинон (смотрите), ванилин (смотрите), с т и ф ни новая кисло т.а (трини-трорезорцин); последняя является чатым веществом и желтой краской для шерсти и шел-
ка; получают ее действием разбавленной азотной кислоты на резорцин. он
Флороглюцин
/Ч
симмет-
рич. триоксибензол (ί°ω. 217°), применяется как реактив на фурфурол (смотрите) и для открытия древесины в бумаге (красное окрашивание).
Лит.: N о и у e I О., Die Industrie der Pbenol-Aldehyd-Harze, Halle a/S„ 1931; Lunge G. u. KShler H„ Die Industrie des Steinkohlenteers und des Ammoniaks, 5 Aufl., В. 1, p. 724—772, Brschw., 1912. Л. Зорохозич.