 > Техника, страница 89 > Формальдегид
> Техника, страница 89 > Формальдегид
Формальдегид
Формальдегид, альдегид муравьиной кислоты НСНО, простейшее соединение гомологии. ряда альдегидов (смотрите). При обыкновенной t° Ф.—газ с резким специфич. запахом, сгущающийся при охлаждении в жидкость; Ь°киПт-21°; D-20 0,8152; D-80 0,9172; уд. в водных растворов Ф. см. табл. 1; парциальное давление его водных растворов см. табл. 2. При сильном охлаждении жидкость замерзает в твердый Ф. (t°пл. —92°). Жидкий Ф. устойчив только при низких t° уже при t°Kun. он со значительным выделением тепла быстро превращается в полимерные модификации. Теплота сгорания газообразного Ф. (при постоянном объёме)
СН20 + 02=Н20+С02 4-134,1 cal.
Теплота образования
Салмаз + ^гОг-ЬН2=СН2Огаз 4-27,8±0,1 cal (пост, объём);
теплота превращения газообразного Ф. в полимеры (параформальдегид) 12,0 cal. Ф. хорошо растворяется в воде; в нек-рых условиях можно получить водные растворы с содержанием СН20 до 55%. При нагревании свыше 300° Ф. заметно разлагается по ур-ию: CH20=CO-f Н2. Термин, распад в стеклянном сосуде протекает по нулевому порядку гетерогенно; скорость распада в пределах 300 -г- 700° возрастает почти в линейной зависимости от t°.
Таблица 1 .—У д. вес водных растворов Ф.
| Уд. вес D * | Содержание СН20 в г | Уд. вес В 18 | Содержание СН20 в г | ||
| в 100 г раствора | в 100 см3 раствора | в 100 г раствора | в 100 см3 раствора | ||
| 1,000 | 0,5 | 0,5 | 1,065 | 21,4 | 22,8 |
| 1,005 | 2,1 | 2,1 | 1,070 | 23,0 | 24 6 |
| 1,010 | 3,7 | 3,8 | 1,075 | 24,6 | 26,5 |
| 1,015 | 5,4 | 5,4 | 1,080 | 26,2 | 28,3 |
| 1,020 | 7,0 | 7,1 | 1,085 | 27,8 | 30,1 |
| 1,025 | 8,6 | 8,8 | 1,090 | 29,3 | 32,0 |
| 1,030 | 10,2 | 10,5 | 1,095 | 30,9 | 33,8 |
| 1,035 | 11,8 | 12,2 | 1,100 | 32,5 | 35,7 |
| 1,040 | 13,4 | 14,9 | 1,105 | 34,0 | • 37,6 |
| 1,045 | 15,0 | 15,7 | 1,110 | 35,6 | 39,5 |
| 1,050 | 16,7 | 17,5 | 1,115 | 37,2 | 41,4 |
| 1,055 | 18,2 | 19,3 | 1,120 | 38,7 | 43,4 |
| 1,060 | 19,8 | 21,0 | 1,125 | 40,3 | 45,3 |
Таблица 2.—3 ависимость парциального давления водных растворов Ф. (в миллиметров Hg) о т ί° и содержания Ф. в растворе.
| ί° |
Содержание СН20 в растворе в % | ||||||
| 5 | 10 | • 15 | 20 | 25 | 30 | 35 | |
| 0
20 35 45 |
0,605 | 0,070
0,351 1,150 2,21 |
0,098
0,487 1,580 3,11 |
0,120
0,600 1,960 3,89 |
0,140
0,714 2,280 4,56 |
0,160
2,570 5,14 |
2,850
5,57 |
Газообразный Ф. при обыкновенной t° частично полимеризуется, причем полимеризация ускоряется различными примесями, особенно водой. В водных растворах Ф. существует пови-димому в виде гидрата СН2(ОН)2 наряду с гидратированными полимерами.
Исследования но разгонке водных растворов Ф. привели к весьма противоречивым результатам. Лэдбури и Блэр нашли, что 30%-ный раствор ведет себя, как жидкость с постоянной tmm,; по данным других авторов минимум t°Kwn. соответствует 8%-ным растворам. Циммерли посредством колонки с обратным охлаждением получил из слабых растворов (16—18% СН20) концентрированные с содержанием Ф. более 40%. Эти противоречия повиди-мому объясняются различными степенями гидратации и полимеризации Ф., которые зависят не только от наличия примесей в растворах, особенно солей и кислот, но и от продолжительности хранения и ряда других причин. Однако концентрирование слабых растворов Ф. и полу чение твердых модификаций (параформальдегида) вполне возможно и легко осуществляется с минимальными потерями посредством разгонки слабых растворов Ф. при уменьшенном давлении; при этом концентрат остается в перегонном сосуде.
Водные растворы Ф. с течением времени мутнеют вследствие выделения продуктов полимеризации. Чем выше концентрация и чем ниже t°, тем быстрее и полнее протекает полимеризация. В присутствии метилового а полимеризация задерживается, поэтому для стабилизации растворов Ф. к ним добавляют некоторое количество метилового а. Существующий в продаже формалин (название введено германской фирмой Шеринг) представляет собой водный раствор Ф., содержащий в 100 см3 40 г СН20 (или 37% по весу) и около 12% метилового а. На заграничном рынке имеются также 30%-ные растворы Ф. без метилового а.
Способы получения. Ф. образуется при неполном сгорании многих органич. веществ (углеводородов, углеводов, древесины и тому подобное.). Он является также повидимому одним из первичных продуктов растительного фотосинтеза (ассимиляция углекислоты растениями). Полимерный Ф. (параформальдегид) был синтетически впервые получен Бутлеровым (1859 г.) из йодистого метилена и уксуснокислого серебра. Получение Ф. в чистом виде было осуществлено Кекуле в 1892 г. Обычный способ получения альдегидов (смотрите), путем сухой перегонки кальциевых солей соответствующих к-т, для получения Ф. не пригоден. Лучше, но далеко не удовлетворительно происходит образование Ф. при перегонке формиатов олова. Из различных реакций, ведущих к образованию Ф., с практич. точки зрения заслуживают внимания следующие:
I. СНз0Н4-1/202=СН20 4-Н20,
И- СН44-02=СН20 4-Н20,
III. СН2С124-Н20=СН20 4-2НС1.
До настоящего времени промышленное получение Ф. велось исключительно из метилового а (метанола) на основе реакции (I). Возрастающая с каждым годом потребность в Ф., гл. обр. для удовлетворения нужд пром-сти пластич. масс, заставила заняться детальным изучением реакций, использующих более дешевое и доступное сырье. В результате этой работы были разработаны другие способы, пока еще не получившие полного промышленного оформления, но давшие, по крайней мере в виде модельно-опытных испытаний, вполне благоприятные показатели для их осуществления в промышленно-заводских масштабах.
Получение Ф. из метилового голя. Этот метод заключается в том, что пары метилового голя в смеси с воздухом (кислородом) пропускают при повышенной t° через катализаторы, способствующие окислению метилового а в Ф. Первые наблюдения над образованием Ф. из метилового а на раскаленной платиновой спирали были сделаны в 1867 г. Гофманом. Толленс и особенно Лев усовершенствовали этот способ, применяя вместо платины медную сетку в качестве катализатора. Основанием для производства в технич. масштабе послужили работы Орлова, который не только ввел существенные аппаратурные усовершенствования, но детально изучил реакцию образования Ф. из метилового голя и определил основные условия ее успешного проведения. При от-
сутствии кислорода реакция протекает обратимо по ур-ию сн3он ^ сн2о+н2
с отрицательным тепловым эффектом. При этом катализатор (медь, серебро и тому подобное.) быстро отравляется, реакция замедляется и наконец почти совсем останавливается. В присутствии кислорода (воздуха), то есть в тех условиях, как это совершается в технике, реакция становится экзотермичной за счет сгорания водорода и для своего протекания не требует дополнительного наружного обогрева реакционной камеры. Образующаяся при окислении вода служит растворителем для Ф. Наряду с главной окислительной реакцией имеют место различные побочные процессы, из которых весьма отрицательную роль играет реакция термич. распада первично полученного Ф. на СО и Н2. Сведение роли этой реакции к минимуму является необходимым условием для нормально протекающего процесса. Катализаторами для получения Ф. из метилового голя могут служить различные металлы,из которых наиболее пригодными являются медь и серебро. Последние металлы применяют в виде сеток, обычно плотно свернутых в спирали или цилиндры. Нанесение катализирующего металла на пористые подкладки с целью увеличения метал-лич. поверхности едва ли целесообразно, т. к. обычные подкладки (пемза и тому подобное.) обладают относительно малой теплопроводностью и ухудшают условия отвода избыточного тепла. Аппаратура для получения Ф. из метанола показана на фигуре 1. Воздух, сжатый посредством ком
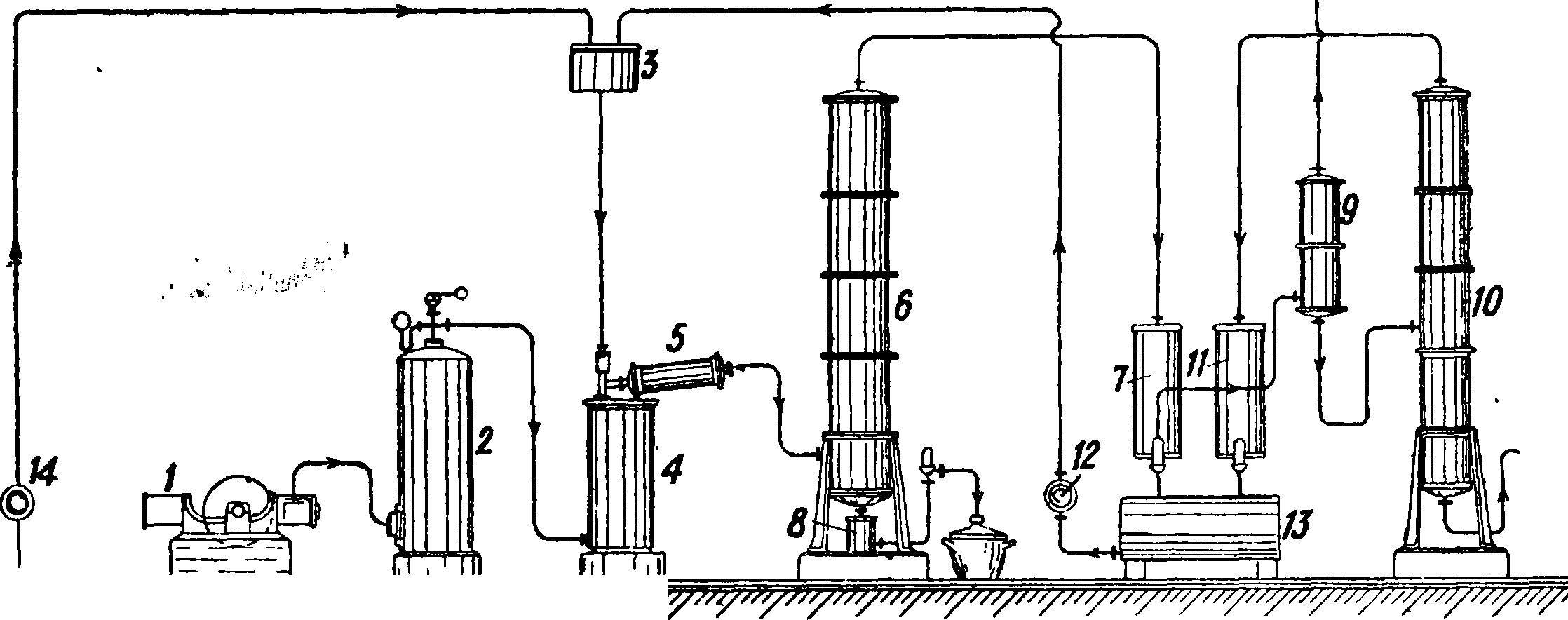
Фигура 1.
прессора 1, из цилиндра 2 направляют в смеситель 4, в к-ром он подогревается и поступает навстречу метанолу, нагретому до t°, обеспечивающей получение смеси необходимого состава, и стекающему из сборника 3. Смесь поступает в контактный аппарат 5, где происходит реакция образования Ф.; продукты реакции и часть исходных веществ, оставшиеся неизмененными (N2; СН20; Н20; СН3ОН; Н2; СО; С02), проходят ректификационный аппарат б, где происходит разделение на Ф., метиловый и неконденсирующиеся газы; Ф. в виде 40%-ного раствора стекает в 8, пары метанола сгущаются в холодильнике 7, откуда посредством насоса 12 снова поступают в сборник 3. Газы, выходящие из 7, поступают в промывал-ку 9, где освобождаются от оставшихся паров метанола, к-рый концентрируется в колонке 10, конденсируется в холодильнике 11 и направляется обратно в сборник 3. Контактный аппарат 5 состоит из шести медных труб (600 миллиметров длиною с просветом 50 миллиметров), по которым распределяется общий поток газовой реакционной смеси; в передней части трубок помещают плотно свернутые контактные сетки длиною в 110 миллиметров.
Нагревание осуществляют паяльной лампой или специальными нагревательными приспособлениями. После того как окисление началось, необходимая температура (450—500°) поддерживается теплом самой реакции. Метиловый голь, применяемый для получения Ф., не должен содержать ацетона свыше I1/2%, так же как и высших кетонов или других органич. соединений, отравляющих катализатор. В случае применения синтетического метанола последний должен быть освобожден от примеси карбонила железа, являющегося сильным каталитическим ядом. Подобными ядами являются также хлор, НС1, S02, соединения а, серы и т. д. На ход процесса окисления и выход Ф. большое влияние имеет состав реакционной смеси. Согласно экспериментальным исследованиям (Леблан и Плашке) оптимальное соотношение по весу между кислородом и метиловым голем следующее:
Кислород : метиловый голь=0,46 : 11 катализатор — Воздух : метиловый голь=2,3 : l медная сетка Кислород : метиловый голь=0,39 : 1 ^катализатор — Воздух : метиловый голь=2,0 : l серебро
В технике пользуются меньшими количествами кислорода, что несколько уменьшает степень превращения метанола, но вместе с тем ведет к снижению t° процесса, а следовательно и к устранению нежелательных побочных реакций и уменьшению потерь. Наблюдение за успешным протеканием процесса осуществляется путем контроля составных частей отходящих газов, которые в случае нормально протекающей реакции должны содержать не более
3,5—4% С02 и десятых долей % СО и СН4. Из 100 килограмм 100%-ного метилового голя должно получиться 93,75 килограмм 100%-ного Ф., что отвечает выходу в 256,9 килограмм 40%-ного (по объёму) раствора Ф. Принимая во внимание, что часть метилового голя намеренно оставляют неизменной для стабилизации растворов Ф., максимально возможный выход сокращается до 196 килограмм 40 %-ного формалина. При проведении процесса в технике удовлетворительными выходами считают 83—85% теории (163—167 килограмм 40%-но-го формалина из 100 килограмм метилового а).
Получение Ф. из метана представляет собой один из наиболее рациональных путей химич. использования природных и тех-нич. (газы коксовых печей, газы полукоксования и других пирогенетич. процессов) метансодержащих газов. Несмотря на большое число исследований и обилие патентов вопрос о рентабельном преврашении метана в Ф. до сих пор еще нельзя считать полностью решенным. Превращение метана в Ф. возможно двумя путями:
1) непосредственным окислением метана и
2) хлорированием метана и дальнейшим гидролизом полученных хлоропроизводных. Многочисленные попытки западноевропейских исследователей по непосредственному окислению метана в Ф. как без катализаторов, так и в присутствии различных катализаторов в общем привели к мало удовлетворительным результатам: количества полученного Ф. были весьма малы, и большая часть метана непроизводительно окислялась в СО и С02. Лучшие результаты были получены америк. исследователями (Бибб, Лэнг, Фролих и др.) при окислении ме-
тана кислородом (воздухом) в присутствии окислов азота. По данным Лэнга при многократном пропускании смеси, состоящей из метана, кислорода и небольшого количества окислов азота (2—5%), через трубки из тугоплавкого стекла или кварца при 690° получается 205 мг Ф. на 1 л разложенного метана, что при пересчете на взятый метан составляет 13,34%; при этом 75,66% метана превращаются в СО и С02.
В результате ряда систематич. исследований, поставленных в физико-химич. ин-те им. Карпова по окислению метана,*был разработан новый способ контактного получения Ф. из метана, давший при модельно-опытном испытании весьма благоприятные результаты. В этом способе в качестве катализаторов применяются огнестойкие соли тяжелых металлов, из которых наиболее пригодными оказались смешанные фосфаты или бораты железа и олова. Для активирования процесса образования Ф. в реакционную газовую смесь вводят небольшое количество газообразного хлористого водорода (0,1-К>,2% по объёму). Смысл прибавления НС1 заключается в том, что процесс протекает по следующей схеме (Me—четырехвалентный металл):
/НР04 Х.НРО4
+4HCl=2Mef +2Н20;
^С12
/Л
2Mef
^0
2 Me
НР04Cl2
+ 02=2Ме:
^НР04
+2С12;
СН4+2 С12=СН2С12+2 НС1;
CH2C12+H20=CH20+2HC1.
Таким образом НС1, связывающийся в начале процесса, полностью регенерируется в конце, то есть играет роль катализатора. Образующийся в процессе хлористый метил омыляется в метиловый, к-рый в условиях реакции также превращается в Ф. Существенным отличием этого способа от других методов получения Ф. из метана является то обстоятельство, что образование Ф. представляет собой главную реакцию, а образование СО и С02 играет подчиненную роль, и потому для проведения процесса оказалось возможным применить циркуляцию реакционной газовой смеси.
Аппаратура для получения Ф. из метана показана на фигуре 2. Реакционная газовая смесь
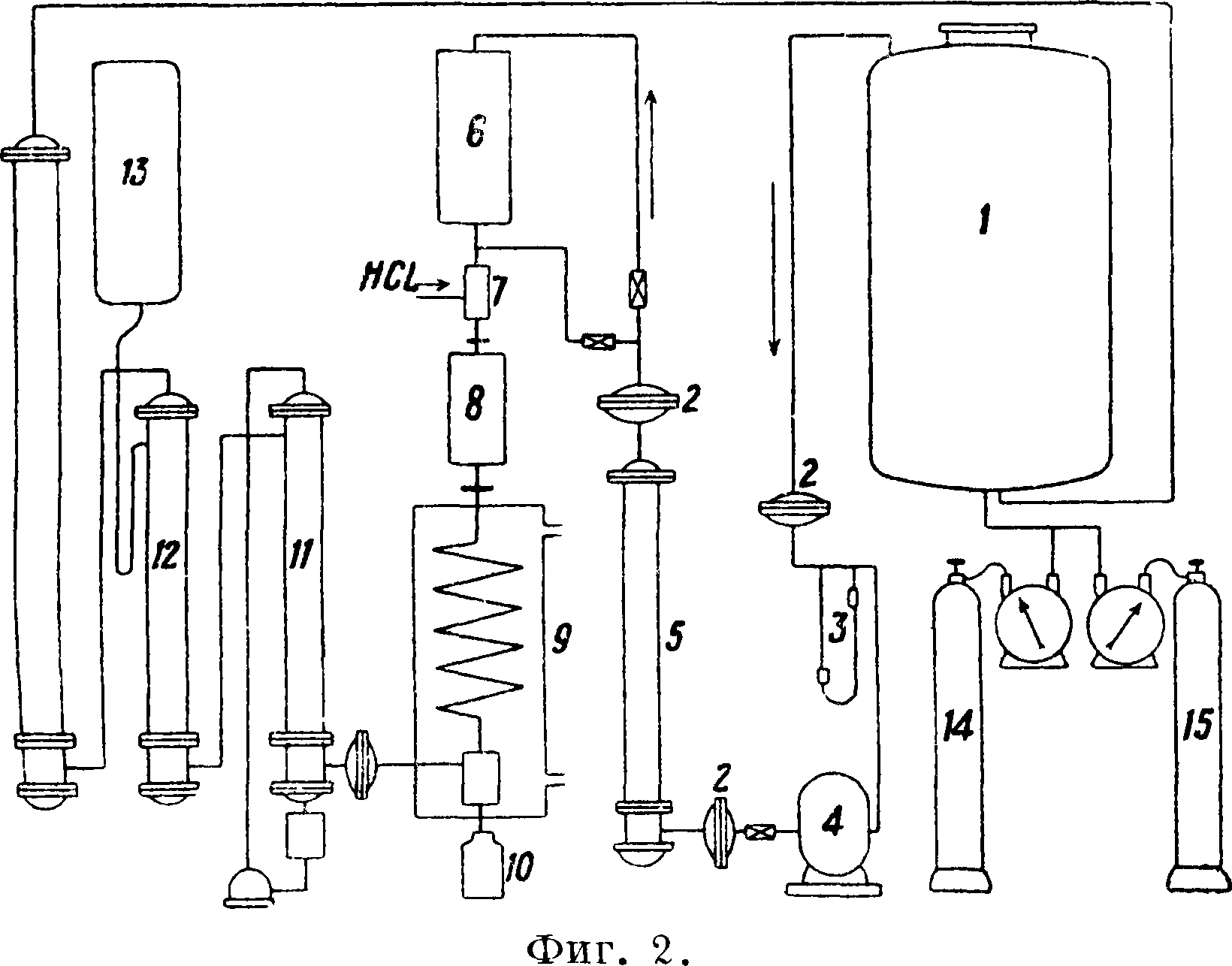
из метансодержащего газа и кислорода (или воздуха), находящаяся в замкнутом резервуаре 1, подается циркуляционным насосом 4 в сушильную колонку 5, а затем в подогреватель 6 и контактный аппарат 8. На пути к контактно му аппарату в смесителе 7 к газу прибавляется нужное количество хлористого водорода. После контактного аппарата газ поступает в холодильник 9, в к-ром главная часть Ф. и паров воды конденсируется и стекает в приемник 10 в виде первичного конденсата, содержащего 25—30% СН20, 1—2% СН3ОН и 6у-10% НС1, а остаток Ф. удерживается водой в колонке с коксом 11. Колонка 12, орошаемая раствором каустика, поступающего из резервуара 13, служит для удержания С02. Отработанный газ, пройдя через ряд колонн, в которых подвергается сушке, снова поступает в резервуар 1, где смешивается с основной массой реагирующего газа и снова подвергается циркуляции. Сокращение объёма, являющееся следствием реакции, компенсируется прибавлением новых порций метансодержащего газа и кислорода из баллонов Ы и 15.
Циркуляция продолжается до тех пор, пока разбавление смеси в результате накопления N2, СО и С02 позволяет вести процесс с достаточной производительностью.
Установка снабжается необходимыми измерительными, предохранительными (чечевицы 2, клапаны и тому подобное.) и саморегулирующими приспособлениями. Один из типов контактного аппарата показан на фигуре 3. Он представляет собой узкую щелевидную камеру прямоугольного сечения (20 х 200 х 1 000 миллиметров), которая заполняется брикетированной контактной массой. Материалом, из которого изготовляют камеру, м. б. железо или, лучше, нержавеющие жароустойчивые сорта стали. Контактная камера находится в бане с расплавленным свинцом, обогреваемой электрич. током, проходящим через хромоникелевую ленту, намотанную снаружи бани и изолированную асбестом; t° контактной массы в течение процесса поддерживают в пределах 595-Р6150. Время контактирования ~0,2 ск. Содержание кислорода в газовой смеси поддерживают на уровне 10—15%. Увеличение концентрации метана вызывает повышение производительности процесса. Поэтому эффективность установки в случае применения воздуха и следовательно разбавления смеси азотом несколько меньше, чем при работе с кислородом. Выходы Ф., получаемые по описанному способу, весьма велики: 70—75% СН4 превращается в Ф. Однако при низкой стоимости метана вести циркуляцию до глубокого его использования нецелесообразно, т. к. наступающее падение концентрации метана в газовой смеси вызывает понижение производительности процесса. Практически использование метана имеет смысл доводить до 30—35% при общем эффекте окисления 65—70%. Средняя производительность при этом составляет 40 г СН20 в 1 час на 1 л активного объёма контактной массы. Первичный конденсат—светложелтая кислая жидкость с содержанием 20—21% СН20— нейтрализуется известью, перегоняется и концентрируется при пониженном давлении. Расход исходных веществ для получения 1 килограмм 40%-ного (по объёму) формалина выражается сл. обр.: природного газа (с содержанием СН480—85%) 860 л, кислорода 920 л, хлористого водорода 70 л и извести 150 г.
Другой путь возможного получения Ф. из метана заключается в том, что метан подвергается хлорированию: хлороформ и четырех
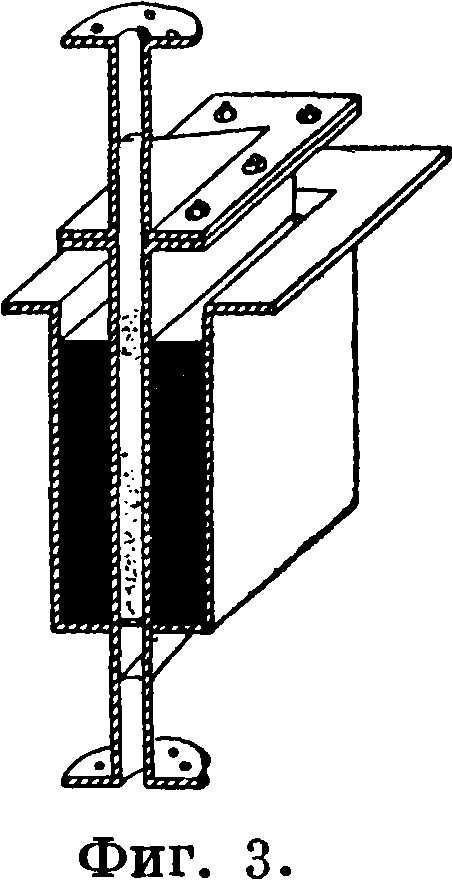
хлористый углерод конденсируются, а хлористый метил и дихлорметан подвергаются омылению. В Физ.-химии, ин-те им. Карпова было показано, что омыление можно осуществить и в первой фазе, пропуская смесь из хлористого метила, хлористого метилена и паров воды через контактную массу, состоящую из фосфата олова, отложенного на пемзе или другой пористой подкладке. Этот способ пока еще не прошел стадии опытных испытаний.
Полимеры Ф. При стоянии концентрированных растворов Ф. или при -выпаривании образуются высокомолекулярные трудно растворимые модификации Ф.
Пар аформальдегид получается при выпаривании растворов Ф. или при быстром охлаждении газообразного Ф.; Представляет собой повидимому смесь из α-,β-и у-полиоксиметиленов. Воздушносухой параформальдегид плавится при 150—160°. В е не растворяется; 100 ч. воды при 18° растворяют 20—30 ч. параформальдегида. При нагревании полностью деполимеризуется. Хорошие сорта параформальдегида должны содержать не менее 95% Ф. и после сожжения оставлять не более 0,5% золы. <х-П олиоксиметилен получается добавлением 1 объёма конц. серной кислоты к 10 объёмам водного Ф. или из параформальдегида при нагревании последнего с 25 %-ной серной к-той или же действием щелочей на 30 %-ный раствор Ф.;при нагревании, не плавясь, испаряется; 1°пл. 163— 168° (в запаянном капилляре). Кристаллич. 0-п о л и о-ксиметиле н—сернокислый эфир полиоксиметилена; получается из концентрированных растворов Ф. при осаждении большим избытком серной к-ты; у-п о л и о к-симетиле н—диметиловый эфир полиоксиметилена, получается при добавлении серной кислоты к растворам Ф., содержащим метанол. Строение <5-п олиоксиметилена (получается при кипячении с водой у-полиоксиметилена) и высокомолекулярного ε-π олиоксиметилена до сих пор не выяснено. а-Т риоксиметилен С8Нв03, полимер Ф. кольцевого строения, получается при пропускании газообразного Ф. в ледяную воду; бесцветные иглы; 100 см3 воды при 18° растворяют 17,2 г. В эфире и других •органич. растворителях хорошо растворим; %°пл. 63—64° <в запаянном капилляре); t°KUn. 114,5°. Сильно летуч при обыкновенной темп-ре; не дает обычных реакций на Ф. п не реагирует с сульфитом. Тетраоксиметилен €4Η804 получается при нагревании в вакууме продуктов взаимодействия между полноксиметиленом и уксусным ангидридом; длинные иглы; t°rvi. 112°. В органич. растворителях растворяется так же, как а-триоксиметилен.
Применение Ф. Особенно большое значение имеют продукты конденсации Ф. с фенолами и крезолами (резолы), ведущей к получению пластич. масс и изоляционных материалов (бакелит, карболит, резинит). Пластич. массы получаются также конденсацией Ф. с казеином (галалит), с мочевиной (смотрите), с клеем, желатиной, альбумином и с другими белковыми веществами. Продукты конденсации с фенолами и мочевиной находят широкое применение в лаковой пром-сти, в приготовлении искусственных дубителей, для проклейки бумаги и тому подобное. Большое технич. значение имеют препараты Ф.—параформальдегйд, гексаметилентетрамин [уротропин (смотрите)] и его бисульфитные и сульфоксилатные соединения. Ф. является также исходным продуктом для получения многих красителей (индиго, розанилин, аурин, акридиновые красители и многие другие). В технике дубления Ф. играет большую роль, особенно при дублении подошвенной кожи (комбинированное дубление). В текстильной пром-сти Ф. применяется для повышения прочности окрасок, для фиксации красителей, пигментов, порошков для облагораживания и отяжеления шелка, повышения прочности искусственного шелка и многих других целей. Широкое применение в крашении, отбелке, печатании находят препараты Ф. — ронгалит, геральдит, декролин и другие соединения с бисульфитом и гидросульфитом. Консервирующие свойства Ф. используются в фотографии и в технике сохранения растительных анатомии, и гистологии. препаратов. Ф. широко применяют как дезинфицирующее средство. В сел. х-ве Ф. применяют для борьбы с вредителями и болезнями растений, для протравливания семян и тому подобное.
Анализ Ф. Помимо образования характерных соединений с анилином, n-нитрофенилгидразином, дифенил-гидразином и тому подобное. для открытия Ф. служат реакции восстановления аммиачных растворов серебра и многочисленные цветные реакции. Из последних особенно чувствительны: красное окрашивание ощелочных растворов флороглюцина, желтое, переходящее в красное окрашивание с резорцином и серной кислотой, реакция с фенилгидразином и нитропруссидным натрием в щелочном растворе и реакция с фуксинсернистой кислотой. Микрохимическое открытие основано на переводе Ф. в характерные кристаллы гексаметилентетрамина. Для количественного определения Ф. особенно пригодны: 1) иодо-метрич. способ Ромина, основанный на окислении щелочного раствора Ф.,
2 J+2NaOH=NaOJ + NaJ+H20;
HCH0 + Na0J+Na0H=HC02Na+NaJ+H20,
2) способ окисления Ф. в щелочном растворе перекисью водорода в муравьиную к-ту и определения неизрасходованной щелочи обратным титрованием:
2HCH0+2Na0H+H202=2HC02Na+H2+2H20 и 3) сульфитный метод, основанный на реакции
CH20 + Na2S03 + H20=CH2(0H)-S03Na+Na0H (титрование образовавшейся щелочи).
Лит.: Медведев С·, Сборник работ Института им. Карпова, М., 1924—25, вып. 3 и 4; его же, Сборник «Природные газы», Москва, 1933; Брюкнер X., Каталитические реакции в химико-органич. пром-сти, пер. с немецкого, ч. 1, Л., 1932; Goldschmidt К., Formaldehyd, Bonn, 1903; Hess О., Formaldehyd ais Desinfektionsmittel, Diss., Marburg, 1898; Hess O., Der Formaldehyd, Marburg, 1901; К lar M., Techno-logie d. Holzverkohlung unter besonderer Beriicksichtigung der Herstellung von samtliehen Halb- u. Ganzfabrikaten aus den Erstlingsdestillaten, 2 Aufl., B., 1909; Ledbury a. Blair, The Production of Formaldehyde by Oxidation of Hydrocarbons, Special Report 1 Department of Scientific a. Industrial Researche, «Chemistry Research», London, 1927; Ltithy M., Ueber die Konstitution d. polymeren Formaldehyd, Diss., Zurich, 1923; Plasch-k e E., Ueber die Umwandlung d. Methylalkohols in Formaldehyd nach dem Kontaktverfahren, Diss., Leipzig., 1903; Yanino L. und Seitter E., Der Formaldehyd, 2 Aufl., W.—Lpz., 1927; Merek L. a Hahn D., Oxidation in the Vapor Fase, 3ΝΓ. Y., 1932; Rideal E. a. Taylor H·, Katalysis in Theory a. Practice, 2 ed., N". Y., 1926.