 > Техника, страница 93 > Эбуллиоскопия
> Техника, страница 93 > Эбуллиоскопия
Эбуллиоскопия
Эбуллиоскопия, совокупность методов измерения повышения t°Kun, раствора по сравнению с чистым растворителем. Э. имеет целью определение молекулярного состояния нелетучего растворенного вещества в растворе и вычисление осмотич. свойств и мол. веса растворенного вещества (смотрите Криоскопия, Осмотическое давление, Растворы). Так же как и понижение точки замерзания раствора, повышение 1кип. ΔΤ8 связано с относительным понижением давления насыщенного пара по сравнению с чистым растворителем: ^. Все эти ти пичные осмотич. свойства раствора определяют- ся существованием в нем осмотич. давления (Р), к-рому пропорционально повышение t°Kun>9определяемое методами“ Э. (смотрите Криоскопия). Основной закон Э., связывающий для слабых растворов повышение t°Kunt с относительным понижением давления насыщенного пара, а следовательно по закону Рауля (смотрите Тонометрия) и с концентрацией раствора с (или с его осмотич. давлением), получается из ур-ия Клапейрона-Клаузиуса в его простейшей форме:
ΔΤ.
Δρ > RTJ Ро ’· QJ
но ~=~ (где п, щ—числа молей растворенного вещества и растворителя в растворе) и
_ п·мо ^ RTI. G0 QJ
при G0=1 000 и п=с ATS=ks · с,
где
При этом допускается, что насыщенный пар раствора вблизи t°Kunm следует ур-ию состояния о1
идеальных газов. Здесь Qs=jf—скрытая теплота испарения чистого растворителя в cal/г в нормальной t°KUflm. Концентрация раствора с выражается при этом в г-моль/1 000 г растворителя. ΔΤβ=Jcs при с=1и потому Jcs называется молекулярным, или молярным, повышением t°Kun.· Значение Jcs не зависит от природы растворенного вещества. В таблице приводятся эбуллиоскопии. свойства некоторых растворителей.
*11
Эбуллиоскопические свойства некоторых растворителей.
| Растворитель | Норм.
t°nun. |
* | ks
(выч.) |
ks (эк-спер.) |
| !
Ртуть .. |
357 | 1
68 |
11,6 | I
1 1М |
| Вода.. | 100 | 539 | 0,516 | 0,51 |
| Бензол .. | 80,3 | 95 | 2,61 | 2,66 |
| Этил,. | 78,2 | 216 | 1,19 | 1,2 |
| Тетрахлорметан. | 78 | 46,8 | 4,9 | — |
| Хлороформ. | 61,2 | 61 | 3,80 | 3,88 |
| Ацетон. | 56,3 | 125 | 1,72 | — |
| Сероуглерод. | 46,2 | 85 | 2,30 | 2,30 |
| Этил, эфир. | 35,0 | 84,7 | 2,14 | 2,16
i |
| * Скрытая теплота испарения (в cal). | ||||
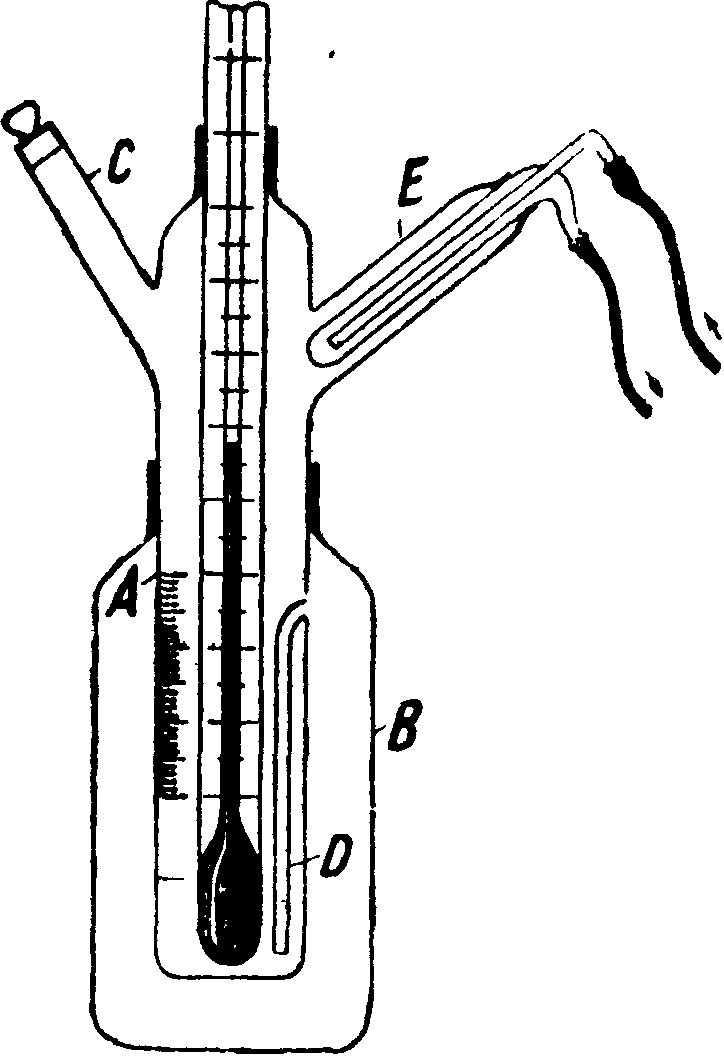
Для эбуллиоскопия, измерений обычно применяется усовершенствованный прибор Бекмана-Руппа (фигура), состоящий из стеклянной муфты В, в к-рую впаян внутренний сосуд А, снабженный делениями по объёму, термометром Бекмана с делениями в 0,01°, холодильником Е для улавливания паров растворителя, трубкой С для введения навески растворяемого вещества и трубкой D, сообщающей внутренний сосуд с муфтой. В муфту наливается растворитель, нагреваемый до кипения; пары его, конденсируясь в холодильнике, переводят часть растворителя в А. После отсчета по термометру, резервуар которого должен быть вполне погружен в жидкость, через С вводятся навески растворен-.ного вещества и после каждой навески вновь измеряется устанавливающаяся t°Kun y соответствующая данной концентрации. Объем растворителя, а следовательно и вес его, участвующий в растворе, определяются по делениям на сосуде А. Впайка внутреннего сосуда может быть заменена шлифом. В случае обычно применяемых органических растворителей с достаточно большим значением ks удобно применять термометры с постоянным ртутным наполнением и делениями в 0,05°. Чтобы такие термометры были достаточно короткими (во избежание значительной поправки на выступающий столбик), применяют целый набор их, охватывающий значительный интервал температуры кипения обычно применяемых растворителей.
Лит.: Вознесенский С. и Ребиндер П., Руководство к лабораторным работам по физич. химии, М.—Л., 1928; Кистяковский В., Прикладная физич. химия, ч. 1, Ленинград, 1926; R i e с h е, «В», 1926, В. 59; Ostwald W., Luther R., Handb. u. Hilfsbuch zur Ausfiihrung phys.-chem. Messungen, 5 Auflage, Leipzig, 1930; Arndt K., Handbuch d. phys.-chem. Technik, 2 Auflage, Stg., 1923; Stahler A., Arbeitsmethoden der anorg. Chemie, В. 1—4, Berlin, 1913—25; Hoube n-W e у 1, Die Methoden der organi-schen Chemie, В. 1—4, Leipzig, 1924—29. П. Ребиндер.